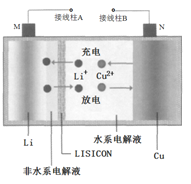
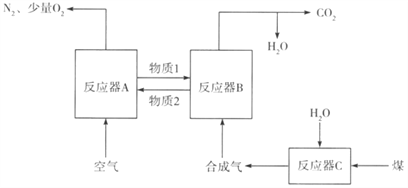
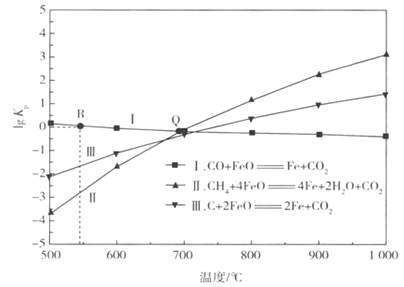
��Ŀ����
����Ŀ���о�NO2��NO��CO��Ⱦ�ﴦ�����Խ��������й�������Ҫ���塣
��1����NO2(g)+CO(g)==CO2(g)+NO(g)��H1=-234.00kJ/mol
��1/2N2(g)+1/2O2(g)=NO(g)��H2=-89.75kJ/mol
��2NO(g)+O2(g)==2NO2(g)��H3=-112.30kJ/mol��
��NO2�����CO���巴Ӧ��������Ⱦ���������Ȼ�ѧ����ʽΪ______________��
��2��ij�¶��£���10L�ܱ������зֱ����0.1molNO2��0.2molCO��������Ӧ��2NO2(g)+4CO(g)=N2(g)+4CO2(g)����10min��Ӧ�ﵽƽ����������ѹǿ��Ϊԭ����![]() ��
��
��0��10min����CO��ƽ����Ӧ����v(CO)=__________��
���������й۲쵽_____�����жϸ÷�Ӧ�ﵽƽ��״̬��
��Ϊ������Ⱦ�ﴦ��Ч�ʣ���ʼ���Ͷ�ϱ�Ϊ______��
��ƽ�����CO��CO2����Ũ�ȷֱ�����һ������ƽ��_____(���������������������������ƶ���)��

��3���ڸ�Ч������������NH3��ԭNO2������Ⱦ�ﴦ����
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ�����ɵ��������ʵ�����ʱ��仯��ͼa�������С����______(��E(A)��E(B)��E(C)��ʾ���ִ����¸÷�Ӧ���)��
���ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ��ͼb����˵��ͼ��������������С��ԭ��________(������¶ȷ�Χ�ڴ�Ч����ͬ)��

��4�����������ں���NO2��������ˮ�м�����������۵Ķ����̿��������ˮ�ľ������Խ�ϵ缫��Ӧ˵�������̿����Ҫ����_____��
���𰸡� 2NO2(g)+4CO(g)=4CO2(g)+N2(g) ��H=-868.8kJ/mol 4��10-4mol/(L.min) ��ϵ��������ɫ���ٸı� ![]() ���ƶ� E(A) ����300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������� ����̿���������γɵ�ԭ�������������������Ӧ2NO2+8H++8e-=N2��+4H2O����NO2ת��Ϊ����Ⱦ����N2
���ƶ� E(A) ����300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������� ����̿���������γɵ�ԭ�������������������Ӧ2NO2+8H++8e-=N2��+4H2O����NO2ת��Ϊ����Ⱦ����N2
����������1����Ӧ�١�4���ڡ�2���ۡ�1�õ���2NO2(g)+4CO(g)=4CO2(g)+N2(g) ��H=-868.8kJ/mol��
��2�� 2NO2(g) + 4CO(g) = N2(g) + 4CO2(g)
��ʼ�� 0.1 0.2 0 0
��Ӧ�� x 2x x/2 2x
ƽ���� 0.1��x 0.2��2x x/2 2x
���º���ѹǿ�ıȵ�����������ʵ����ıȣ�����![]() �����x=0.02mol��
�����x=0.02mol��
�����ϲμӷ�Ӧ��COΪ0.04mol����Ӧ����Ϊ![]() = 4��10-4mol/(L.min)��
= 4��10-4mol/(L.min)��
�ڷ�Ӧ��ƽ���Ժ��������ʵ�Ũ�ȶ����仯����ΪNO2��Ũ�Ȳ��䣬������ϵ����ɫӦ��Ҳ���仯����۲쵽��ɫ���䣬֤����Ӧ��ƽ�⡣
��Ϊ������Ⱦ�ﴦ��Ч�ʣ�Ӧ�ñ�֤��Ӧ����ת��Ϊ�������������Ӧ�ﶼ��������������ʼ���Ͷ�ϱ�Ϊ![]() ��
��
�ܴ�ƽ��ʱһ����Q=K�����ڽ���CO��CO2����Ũ�ȷֱ�����һ������Ϊ���ߵ�ϵ����ȣ���һ���ڷ���һ���ڷ�ĸ������Ũ���̵ı�ֵQ���䣬��Q��Ȼ����K����Ӧƽ�ⲻ�ƶ���
��3����һ����˵����Ӧ�Ļ��ԽС����Ӧ������Խ�죬����E(A)��С��
������Ϊ�ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ���������ϵĵ㲻һ������ƽ��̬����Ӧ��������ʱ��ʱ��β��ܴ�ƽ�⣬������Խ�죬��Ӧ����Խ�ࣻ��Ӧ���ʺܿ��ʱ��Ӧ��ƽ�⣬���¶�Խ�ߣ�ƽ�������ƶ�����Ӧ�������١�����ԭ��Ϊ������300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������С�
��4�������������������ԭ��أ���������̼�������ԭ��ص������缫����Ϊ������̼Ϊ�����������Ӧ�÷���NO2�õ���ת��Ϊ�����ķ�Ӧ�����Է���ʽΪ��2NO2+8H++8e-=N2��+4H2O��

 ��������������������ϵ�д�
��������������������ϵ�д�����Ŀ�����и��������У�����X��Y��Y��Z����ͨ��һ����Ӧ���ת����һ����
ѡ�� | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
����Ŀ��I����һ��������aA��bB![]() cC+dD�ﵽƽ��ʱ������д��
cC+dD�ﵽƽ��ʱ������д��
��1����A��B��C��D�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����a��b��c��d��ϵ��__________________��
��2����֪B��C��D�����壬������A�����ʵ�����ƽ�ⲻ�ƶ���˵��A��__________________����״̬����
��3���������ݻ����䣬��������B������A��ת����__________________����������������С����������������
��4�������Ⱥ�C�İٷֺ�����С��������Ӧ��__________________��Ӧ��������������������������
��5������������ѹǿ���䣬��A��B��C��D�������壬�������г���ϡ�����壬��ѧƽ�������ƶ�����a��b��c��d��ϵ��__________________��
������ҵ��һ��������з�Ӧ�ϳɼ״���CO(g)��2H2(g) ![]() CH3OH(g)��
CH3OH(g)��
��1����һ���¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)��0.5mol��L��1���÷�Ӧ��ƽ�ⳣ��K��__________________��
��2������һ����ɱ�������г���l molCO�� 2mol H2��1mol CH3OH���ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������÷�Ӧ��__________________(����������������)��Ӧ�����ƶ���
��3�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�˷�Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯��Q1��Q2��Q3������0�� |
1 | 2molCO��4molH2 | a1�� | c1 | �ų�Q1kJ���� |
2 | 2molCH3OH | a2�� | c2 | ����Q2kJ���� |
3 | 4molCO��8molH2 | a3�� | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� __________________��
A�� c1=c2 B��2Q1=Q3 C��2a1=a3 D��a1 +a2 =1 E���÷�Ӧ������2mol CH3OH����ų�(Q1+Q2)kJ����
����Ŀ���������ӷ���ʽ����д�����۾���������( )
ѡ�� | ���ӷ���ʽ | ���� |
A | ��2 mol Cl2ͨ�뺬1 mol FeI2����Һ�У� 2Fe2����2I����2Cl2===2Fe3����4Cl����I2 | ��ȷ��Cl2�������ɽ�Fe2����I�������� |
B | Ba(HCO3)2��Һ��������NaOH��Һ��Ӧ�� Ba2����HCO3-��OH��===BaCO3����H2O | ��ȷ����ʽ����Ӧ�������κ�ˮ |
C | ����SO2ͨ��NaClO��Һ�У� SO2��H2O��ClO��===HClO��HSO3- | ��ȷ��˵�����ԣ�H2SO3ǿ��HClO |
D | 1 mol/L��NaAlO2��Һ��2.5 mol/L��HCl��Һ�������ϣ� 2AlO2-��5H��===Al3����Al(OH)3����H2O | ��ȷ����һ����Ӧ�͵ڶ�����Ӧ���ĵ�H�������ʵ���֮��Ϊ2��3 |
A. A B. B C. C D. D