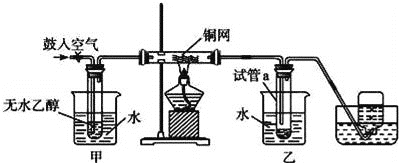
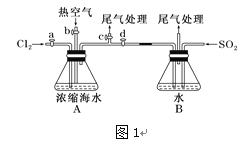
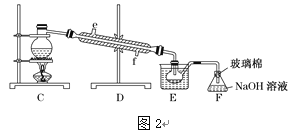
��Ŀ����
����Ŀ��ij��������ϡNaOH��Һ�ѳ�CO2������ϴ�ѳ������÷�Һ��pHԼΪ13(��֪����ͬ�¶��±���Na2CO3��Һ��pHԼΪ12)��������˵����ȷ����
A. ����Һ�У�c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+)
B. ����Һ�У�c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C. ��ˮϡ����Һ���ָ���ԭ�¶ȣ�pH����Kw����
D. ����ҺpHԼΪ13��ԭ��CO32-+H2O=HCO3-+OH-
���𰸡�B
��������
��ϴ�ѳ�CO2�����÷�Һ��pHԼΪ13��������ͬ�¶��±���Na2CO3��Һ��pH��˵����ϴ�ѳ�CO2�����÷�Һ�е�����ΪNaOH��Na2CO3��Na2CO3����Һ�д���ˮ��ƽ�⣺CO32-+H2O![]() HCO3-+OH-��HCO3-+H2O
HCO3-+OH-��HCO3-+H2O![]() H2CO3+OH-��A�����Һ��c��Na+��
H2CO3+OH-��A�����Һ��c��Na+��![]() c��OH-����������B���Һ�еĵ���غ�ʽΪc��Na+��+c��H+��=c��OH-��+2c��CO32-��+c��HCO3-������ȷ��C���ˮϡ�ͻָ���ԭ�¶ȣ���Һ��c��OH-����С��pH��С��ˮ�����ӻ�KW���䣬����D�����ҺpHԼΪ13��ԭ����NaOH=Na++OH-������ѡB��
c��OH-����������B���Һ�еĵ���غ�ʽΪc��Na+��+c��H+��=c��OH-��+2c��CO32-��+c��HCO3-������ȷ��C���ˮϡ�ͻָ���ԭ�¶ȣ���Һ��c��OH-����С��pH��С��ˮ�����ӻ�KW���䣬����D�����ҺpHԼΪ13��ԭ����NaOH=Na++OH-������ѡB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���������������������������������ӦΪ2NO2(g)��O3(g)![]() N2O5(g)��O2(g)����T�¶��£���2.0 L�����ܱ������г���2.0mol NO2��1.0mol O3������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
N2O5(g)��O2(g)����T�¶��£���2.0 L�����ܱ������г���2.0mol NO2��1.0mol O3������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
�����й�˵����ȷ����
A. ��Ӧ��0��3 s�ڵ�ƽ������v(NO2)��0.24 mol��L1��s1
B. ��T�¶��£���ʼʱ�������г���1.0mol NO2��0.5mol O3��0.50mol N2O5��0.50mol O2����Ӧ�ﵽƽ��ʱ��ѹǿΪ��ʼʱ��0.88��
C. 24 s�������������������䣬�����¶ȣ��ﵽ��ƽ��ʱ���c(O2)��0.44mol��L1����Ӧ�Ħ�H>0
D. ��T�¶��£���ʼʱ�������г���2.0mol N2O5��2.0mol O2���ﵽƽ��ʱ��N2O5��ת���ʴ���20%
����Ŀ���������������������������������ӦΪ��2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
A | B | C | D |
|
|
|
|
�����¶ȣ� | 0��3s�ڣ���Ӧ����Ϊ�� | t1ʱ����������� | ��ƽ��ʱ�����ı�x����xΪc(O2) |