题目内容
18.下表是元素周期表的一部分,回答下列有关问题:| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
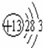 ;⑪
;⑪ .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
(7)元素①是动植物生长不可缺少的元素,是蛋白质的重要成分.其氢化物常用作制冷剂,该氢化物的电子式为:
 ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).
分析 由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br.
(1)④、⑫分别为Mg、Br;
(2)⑤为Al、⑪为Ca,结合核外电子排布书写原子结构示意图;
(3)同周期从左向右元素的金属性减弱,非金属性增强,同主族从上到下元素的金属性增强,非金属性减弱;
(4)比较非金属性强弱,可根据氢化物的稳定性或者对应的最高价氧化物的水化物的酸性强弱;
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素形成的化合物为NaCl;
(6)现代光学及光纤制品的基本原料为二氧化硅;
(7)①为N,对应的氢化物为氨气,结合v=△c△t计算反应速率.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br.
(1)由以上分析可知④、⑫分别为Mg、Br,故答案为:Mg; Br;
(2)⑤为Al,原子核外有3个 电子层,最外层电子数为3,原子结构示意图为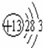 ,⑪为Ca,原子核外有4个 电子层,最外层电子数为2,原子结构示意图为
,⑪为Ca,原子核外有4个 电子层,最外层电子数为2,原子结构示意图为 ,故答案为:
,故答案为: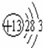 ;
; ;
;
(3)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素Cl(⑧)和Br中,Cl最活泼;最不活泼的是⑨即Ar,
故答案为:K;F;Ar;
(4)元素⑦与元素⑧相比,非金属性较强的是Cl,比较非金属性强弱,可根据氢化物的稳定性或者对应的最高价氧化物的水化物的酸性强弱,聚集状态属于物理性质,与化学性质无关,与氢氧化钠反应不能比较非金属性强弱,
故答案为:Cl;b;
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素形成的化合物为NaCl,为离子化合物,故答案为:离子;
(6)现代光学及光纤制品的基本原料为二氧化硅,化学式为SiO2,为共价化合物,含有共价键,故答案为:SiO2;共价;
(7)①为N,对应的氢化物为氨气,电子式为 ,在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,发生N2+3H2?2NH3,半分钟后测得生成物的物质的量为1.4mol,则消耗0.7molN2,
,在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,发生N2+3H2?2NH3,半分钟后测得生成物的物质的量为1.4mol,则消耗0.7molN2,
v=△c△t=0.7mol4L0.5min=0.35mol/(L•min),
故答案为: ;0.35mol/(L•min).
;0.35mol/(L•min).
点评 本题考查元素的位置、结构和性质的推断,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意元素周期律的递变规律等知识的积累.

 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | V(H2)=0.3 mol•L-1•min-1 | B. | V(NH3)=0.01 mol•L-1•s-1 | ||
| C. | V(N2)=0.2 mol•L-1•min-1 | D. | V(H2)=0.01 mol•L-1•s-1 |
| A. | 物质的实验式就是其分子式 | |
| B. | 质谱法可以测定物质的相对分子质量 | |
| C. | 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息 | |
| D. | 从核磁共振氢谱图可以推知该有机物分子有几种不同类型的氢原子及他们的数目之比 |
| A. | 在潮湿疏松透气的土壤中 | B. | 在干燥致密不透气的土壤中 | ||
| C. | 在含铁元素较多的酸性土壤中 | D. | 在含碳粒较多,潮湿透气的土壤中 |
| A. | S区的元素一定是主族元素 | B. | d区元素一定是副族元素 | ||
| C. | p区的元素一定是主族元素 | D. | ds区元素一定是副族元素 |
| A. | 过滤 | B. | 结晶 | C. | 蒸馏 | D. | 升华 |
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.