题目内容
【题目】A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第_______周期________族,它的最高价氧化物的化学式为____________。
(2)B是________元素。
(3)写出B 和 D组成化合物的形成过程______________________________________。
(4)A与D形成稳定的化合物的化学式为______________,将该化合物加入含有酚酞的水作用实验现象是____________________________________________________________。
(5)C元素的单质有毒,可用A 的最高价氧化物对应的水化物的溶液吸收,其离子方程式为_________________________________________________________________________。
【答案】 三 ⅦA Cl2O7 Mg 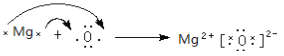 Na2O2 溶液先变红后褪色,产生无色气泡 Cl2+2OH-=Cl-+ClO-+H2O
Na2O2 溶液先变红后褪色,产生无色气泡 Cl2+2OH-=Cl-+ClO-+H2O
【解析】A元素的离子具有黄色的焰色反应,则A为![]() ;B元素的离子结构和
;B元素的离子结构和![]() 具有相同的电子层排布,
具有相同的电子层排布,![]() 的氢氧化物恰好能与
的氢氧化物恰好能与![]() 盐酸完全反应;B原子核中质子数和中子数相等,所以B为
盐酸完全反应;B原子核中质子数和中子数相等,所以B为![]() ;
;![]() 在C单质中燃烧产生苍白色火焰,所以C为
在C单质中燃烧产生苍白色火焰,所以C为![]() ;D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍,所以D为
;D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍,所以D为![]() 。
。
(1)元素C为氯,位于第三周期ⅦA族,它的最高价氧化物的化学式为![]() ;正确答案:三 ;ⅦA ; Cl2O7。
;正确答案:三 ;ⅦA ; Cl2O7。
(2)根据以上分析可知B为![]() ,正确答案:Mg。
,正确答案:Mg。
(3)写出B 和 D组成化合物为氧化镁,其电子式形成过程为: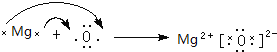 ;正确答案:
;正确答案: 。
。
(4)A与D形成稳定化合物的化学式为![]() ,过氧化钠具有强氧化性,与含有酚酞的水反应生成氢氧化钠和氧气(有气泡),溶液先变红后褪色;正确答案:溶液先变红后褪色,产生无色气泡。
,过氧化钠具有强氧化性,与含有酚酞的水反应生成氢氧化钠和氧气(有气泡),溶液先变红后褪色;正确答案:溶液先变红后褪色,产生无色气泡。
(5)C元素的单质![]() 有毒,可用A的最高价氧化物对应的水化物的溶液
有毒,可用A的最高价氧化物对应的水化物的溶液![]() 吸收,其离子方程式为
吸收,其离子方程式为![]() ;正确答案: Cl2+2OH-=Cl-+ClO-+H2O。
;正确答案: Cl2+2OH-=Cl-+ClO-+H2O。

 初中暑期衔接系列答案
初中暑期衔接系列答案