题目内容
【题目】原子序数小于36 的X、Y、Z、W四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
(1)Y2X2 中Y原子的杂化类型为 , 1mol Y2X2 含有σ键的数目为 .
(2)Y的一种氧化物与Z 的一种氧化物互为等电子体,Z 的这种氧化物分子式是 .
(3)标准状况2.24L Z 的简单氢化物溶于Z 的最高价氧化物的水化物稀溶液,放热Q kJ,该反应的热化学方程式为 .
(4)元素W 的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 , 氯化物晶体溶于足量Z 的最高价氧化物的水化物的浓溶液反应的离子方程式为 . 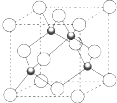
【答案】
(1)sp杂化;3×6.02×1023
(2)N2O
(3)NH3(g)+HNO3(aq)=NH4NO3(aq)△H=﹣10Q kJ/mol
(4)CuC;CuCl+NO3﹣+2H+=Cu2++Cl﹣+NO2↑+H2O
【解析】解:原子序数小于36的X、Y、Z、W四种元素,其中X是形成的单质是最轻的物质,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素.(1)Y2X2是乙炔,分子式为C2H2 , 碳氢原子之间存在σ键,碳碳三键中含有一个σ键,所以每个碳原子含有2个σ键,采取sp杂化,一个乙炔分子中含有3个σ键,所以1mol Y2X2含有σ键3×6.02×1023个,所以答案是:sp杂化;3×6.02×1023;(2)CO2和N2O的原子个数相等、价电子数相等,所以是等电子体,所以答案是:N2O;(3)Z的简单氢化物为氨气,Z 的最高价氧化物的水化物稀溶液为稀硝酸,标准状况2.24L 氨气为0.1mol,溶液稀硝酸放热Q kJ,则1mol氨气反应放出热量为10Q kJ,该反应的热化学方程式为:NH3(g)+HNO3(aq)=NH4NO3(aq)△H=﹣10QkJ/mol,所以答案是:NH3(g)+HNO3(aq)=NH4NO3(aq)△H=﹣10QkJ/mol;(4)利用均摊法知,该晶胞中黑色球个数=4,白色球个数= ![]() =4,黑色球和白色球的个数之比=4:4=1:1,所以该物质的化学式是CuCl,它可与浓硝酸发生氧化还原反应,其反应方程式为:CuCl+NO3﹣+2H+=Cu2++Cl﹣+NO2↑+H2O,所以答案是:CuCl;CuCl+NO3﹣+2H+=Cu2++Cl﹣+NO2↑+H2O.
=4,黑色球和白色球的个数之比=4:4=1:1,所以该物质的化学式是CuCl,它可与浓硝酸发生氧化还原反应,其反应方程式为:CuCl+NO3﹣+2H+=Cu2++Cl﹣+NO2↑+H2O,所以答案是:CuCl;CuCl+NO3﹣+2H+=Cu2++Cl﹣+NO2↑+H2O.

 阅读快车系列答案
阅读快车系列答案