题目内容
3.烃A最多可以与两倍于其物质的量的H2加成.当烃A与足量HCl加成后产物为B,B与四倍于其物质的量的Cl2反应才能得到完全卤代的产物.烃A是( )| A. | CH2═CH-CH═CH2 | B. | CH≡CH | C. | CH3C≡CH | D. | CH2═CH2 |
分析 烃A最多可以与两倍于其物质的量的H2加成”表明A中含有一个三键或者两个双键,当烃A与足量HCl加成后产物为B,则A能和2倍的氯化氢加成生成B,故B比A多了2个H和两个Cl,再根据B与四倍于其物质的量的Cl2反应才能得到完全卤代的产物可知B分子中有4个H,由此可推出A的分子式.
解答 解:烃A最多可以与两倍于其物质的量的H2加成”表明A中含有一个三键或者两个双键.
又由“B与四倍与其物质的量的Cl2反应才能得到完全卤代的产物”可见只含有单键的B中有四个氢原子,算上加上去的两个氯原子,
故B的化学式为:C2H4Cl2,可以推断A为乙炔.
故选B.
点评 本题考查了有机物分子式的确定,为高频考点,掌握加成反应和取代反应的特点是解题的关键,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
6.常温下经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
3.下列各组物质,既不是同系物也不是同分异构体的是( )
| A. |  和 和 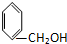 | B. | 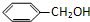 和 和 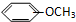 | ||
| C. | (CH3)2C(OH)CH2CH3 和CH3CH2OH | D. | CH3CH2OH 和 CH3CH2OCH2CH3 |
10.甲、乙、丙、丁分别是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
8.用CO还原15.0g某磁铁矿石样品(所含的杂质不参加反应),生成的CO2再跟过量的石灰水反应,得到19.2g沉淀.则求磁铁矿石中Fe3O4的质量分数为( )
| A. | 68.3% | B. | 74.2% | C. | 92.2% | D. | 78.1% |
15.下列说法正确的是( )
| A. | 每一个化学反应都会伴随着能量变化 | |
| B. | 氯化氢溶于水氢氯共价键被破坏 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物 |
12.有一位同学预测120号元素可能具有的性质中,不正确的是( )
| A. | 位于第八周期,第ⅡA族 | |
| B. | 最高价氧化物对应水化物具有强碱性 | |
| C. | 此元素的原子半径较大,熔沸点很高 | |
| D. | 属于人造元素,自然界不存在,并具有放射性 |
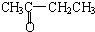 B.
B.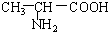 与
与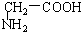
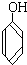 与
与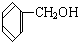 D.CH3CH2C≡CH与CH2=CH-CH=CH2
D.CH3CH2C≡CH与CH2=CH-CH=CH2 与
与  F.戊烯和环戊烷
F.戊烯和环戊烷