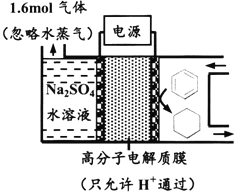
题目内容
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,用化学用语回答下列有关问题。

(1)其中属于阴离子的是_____;
(2)其中化学性质最稳定的是_____;
(3)已知A元素的某种核素的中子数为18,该核素的符号是_____;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该元素的离子结构示意图为_____。
【答案】O2 Ne 35Cl 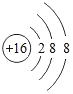
【解析】
(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B. C. D.E分别是Cl、O2、Ne、Na、Mg2+,则属于阴离子的是O2;
(2)最外层电子达到稳定结构时该微粒性质最稳定,所以性质最稳定的是Ne;
(3)已知A元素的某种核素的中子数为18,质子数为17,质量数=质子数+中子数=18+17=35,该核素的符号是35Cl;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子为6个,则核电荷数为16,为硫元素,该元素的离子为得到两个电子的阴离子,该元素的离子结构示意图为: 。
。

练习册系列答案
相关题目