题目内容
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
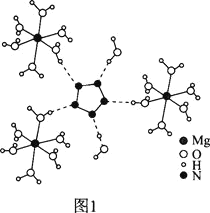
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
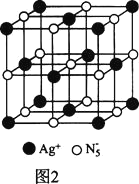
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。
【答案】3d7 ds Z X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则Z是氮元素 配位键 氢键 sp2 ![]()
![]()
![]()
【解析】
(1)镍的原子序数为28,则基态Ni3+的价电子排布式为3d7;银与铜位于同一族,银元素位于元素周期表的ds区;
(2)①X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大;
②镁离子与水之间是水分子中的氧原子提供孤电子对,镁离子提供空轨道,形成配位键,N5-与H2O之间NH-O氢键;
③ N5-为平面正五边形,N原子的杂化类型是sp2;
(3) 根据晶胞粒子的排布,确定晶胞中微粒的个数,根据ρ=![]() 计算
计算
(1)镍的原子序数为28,则基态Ni3+的价电子排布式为3d7;银与铜位于同一族,银元素位于元素周期表的ds区;
(2)①X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则Z是氮元素,Y是氧元素;
②镁离子与水之间是水分子中的氧原子提供孤电子对,镁离子提供空轨道,形成配位键,N5-与H2O之间NH-O氢键;
③ N5-为平面正五边形,N原子的杂化类型是sp2;N4-中每一个氮原子的sp2杂化轨道有2个形成σ键,一个是孤电子对,还有一个垂直于氮原子形成平面的p轨道,只有1个电子,p轨道间形成1个大π键,N4-得到1个电子,故电子数是5个,则N4-中的大π键应表示为![]() ;
;
(3)Ag+周围距离最近的Ag+有12个。1个晶胞中含有4个Ag+,4个N5-,1个晶胞的体积为(2a×10-7)cm3,则AgN5的密度可表示为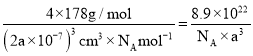 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案