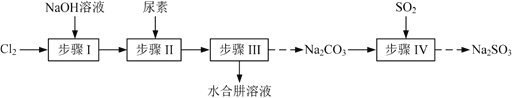
题目内容
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
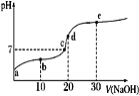
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
【答案】B
【解析】
A.根据电离常数计算可得a点溶液的c(H+)=![]() =4×10-4mol·L-1,A正确;B.d点恰好反应生成的盐水解,水电离程度最大,B错误;C.b点根据物料守恒可得2c(Na+)=c(CH3COO-)+c(CH3COOH),C正确;D.d点溶液中只有醋酸钠,根据质子守恒可得c(OH-)=c(CH3COOH)+c(H+),D正确。答案选B。
=4×10-4mol·L-1,A正确;B.d点恰好反应生成的盐水解,水电离程度最大,B错误;C.b点根据物料守恒可得2c(Na+)=c(CH3COO-)+c(CH3COOH),C正确;D.d点溶液中只有醋酸钠,根据质子守恒可得c(OH-)=c(CH3COOH)+c(H+),D正确。答案选B。

【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D