题目内容
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是

A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应完全后,可用仪器a、b蒸馏得到产品
C.实验过程中若发现仪器b中未加入碎瓷片,可冷却后补加
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸, 待冷却至室温后,将所得混合物加入苯中
【答案】B
【解析】
A.水浴加热可保持温度恒定,即水浴加热的优点为使反应物受热均匀、容易控制温度,但注意温度最高加热到100℃,故A正确;
B.反应完全后,硝基苯与酸分层,应选分液漏斗分离,粗产品用蒸馏烧瓶(不用a圆底烧瓶)和冷凝管蒸馏得到硝基苯,故B错误;
C.碎瓷片在温度低时加入,防止液体暴沸,实验过程中若发现仪器b中未加入碎瓷片,不能再继续实验,也不能立即加入碎瓷片,需冷却后补加,故C正确;
D.混合时要使热量及时散失,防止苯挥发,由于浓硫酸的密度大于浓硝酸,为避免液体迸溅,应向浓硝酸中加入浓硫酸,待冷却后,将所得的混合物加入苯中,故D正确;
答案为B。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
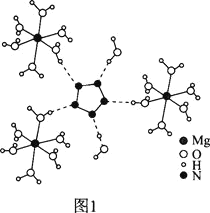
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
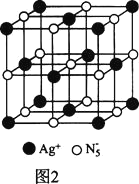
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。