题目内容
【题目】下列反应中一定属于吸热反应的是( )
A.需加热或点燃才能引发的反应
B.氧化还原反应
C.氢氧化钡晶体和氯化铵晶体混合搅拌
D.一氧化碳和氧气反应
【答案】C
【解析】解:A.燃烧反应需要加热或点燃引发,但是燃烧属于放热反应,故A错误;
B.氧化还原不一定属于放热反应,故B错误;
C.氢氧化钡与氯化铵反应属于吸热反应,故C正确;
D.一氧化碳与氧气反应属于燃烧,是放热反应,故D错误,故选C.
【考点精析】掌握吸热反应和放热反应是解答本题的根本,需要知道化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应.

 53随堂测系列答案
53随堂测系列答案【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
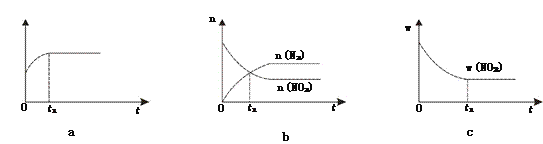
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。

图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
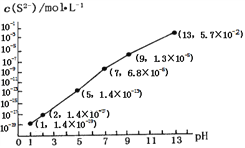
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
【答案】 b A 2MPa c(HCO3- )>c(NO2- )>c(CO32-) 0.043或4.3×10-2 碱性 此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性 -399.7
【解析】(1)①根据“变量不变达平衡”判断,a、反应中碳是固体,恒容条件下的混合物的密度是变量,t1时刻密度不变说明反应已达平衡状态;b、t1时刻是n(N2)=n(NO2),是反应物量的特殊比例,且后面量的变化可看到各反应物的量还没恒定,还没达到平衡状态;c、t1时刻二氧化氮的质量分数不变,则反应物各物质的质量分数也应不变,反应达到平衡状态;答案选b;②A、B、C三点中达到平衡状态后A点NO2浓度最小,所以NO2的转化率最高;③由焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生反应在C点时,NO2和CO2的物质的量浓度相等,可知此时反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,则三种物质的分压分别为:P(NO2)= P(CO2)=10MPa×![]() =4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)=
=4MPa,P(N2)=2MPa,C点时该反应的压强平衡常数Kp(C)= 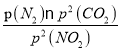 =
=![]() =2MPa;(2)①由亚硝酸的电离平衡常数Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判断亚硝酸的酸性强于碳酸,因此向含有2mol碳酸钠的溶液中加入1mol的HNO2后生成1mol碳酸氢钠、1mol亚硝酸钠,另外还剩余1mol碳酸钠,水解程度大小顺序为CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-离子的浓度大小关系为c(HCO3- )>c(NO2- )>c(CO32-);②根据物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由图可知pH=13时,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈碱性,其定量依据是此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性;(3)已知:①CaSO4(s)+CO(g)
=2MPa;(2)①由亚硝酸的电离平衡常数Ka=5.1×10-4,H2CO的Ka1=4.2×10-7、Ka2=5.61×10-11可判断亚硝酸的酸性强于碳酸,因此向含有2mol碳酸钠的溶液中加入1mol的HNO2后生成1mol碳酸氢钠、1mol亚硝酸钠,另外还剩余1mol碳酸钠,水解程度大小顺序为CO32->NO2-,水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-离子的浓度大小关系为c(HCO3- )>c(NO2- )>c(CO32-);②根据物料守恒有c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,而由图可知pH=13时,c(S2-)=5.7×10-2 mol·L-1,c(H2S)+c(HS-)=0.10 mol·L-1-c(S2-)=0.10 mol·L-1-5.7×10-2 mol·L-1= 4.3×10-2 mol·L-1;③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈碱性,其定量依据是此时恰好生成NaHS溶液,Ka(HS-)=7.1×10-15<Kh(HS-)=KW/ Ka1(H2S)=10-14/(1.3×10-7)=7.7×10-8,即水解程度远大于电离程度,所以呈碱性;(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H1= +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2= -189.2kJmol-1
CaS(s)+4CO2(g) △H2= -189.2kJmol-1
根据盖斯定很,由②-①得反应:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
CaS(s)+3CO2(g) △H=△H2-△H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1。
点睛:本题主要是考查了弱电解质的电离、弱电解质的水解以及反应热计算等。该题考查的知识点较多,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用。难点是电离平衡常数以及盐类水解的应用。解答时要明确电离平衡常数与化学平衡常数一样,平衡常数越大弱电解质的电离程度越大,从而可以判断相应酸碱的相对强弱,进而可以判断相应的盐的水解程度大小。(2)②中的计算要注意灵活应用物料守恒,同时要注意结合图像进行分析与计算。
【题型】综合题
【结束】
9
【题目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5℃,熔点为-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能与强碱反应。
BCl3+3H2 ,硼也能与强碱反应。
某研究性学习小组用如下所示装置制备三氯化硼。回答下列问题:
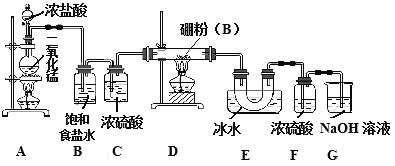
(1)A装置中反应的离子方程式_______________________。
(2)B装置的作用是____________;如果拆去B装置,可能的后果是__________________。
(3)D装置中发生反应的化学方程式_____________。
(4)G装置的作用是_____;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是___,所装试剂是____。
(5)A、D两处加热的先后顺序是_____________,其理由是_______________。
(6)检验制得的产品中是含有硼粉的实验操作是________________________。
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
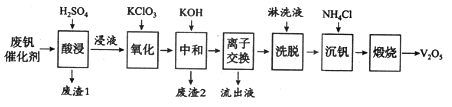
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。