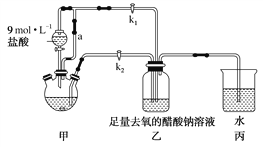
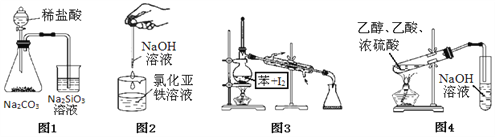
题目内容
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,质量比为________。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①________是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。_________________
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
【答案】 1:1 7:11 浓硫酸 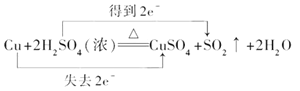 26.88L 2.4NA(或者1.4448×1024)
26.88L 2.4NA(或者1.4448×1024)
【解析】(1)同温同压下,相同体积的任何气体具有相同数目的分子;因此两瓶体积相等的CO和CO2,气体的物质的量相等,物质的量之比等于气体的分子数之比,因此两种气体中所含的分子数目之比为1:1;由于气体的物质的量相等,所以气体质量之比等于气体摩尔质量之比:28:44=7:11;正确选项:1:1; 7:11。
(2)①Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,浓硫酸做氧化剂;正确答案:浓硫酸。
CuSO4+ SO2↑+ 2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,浓硫酸做氧化剂;正确答案:浓硫酸。
②铜失电子数:2-0=2,硫酸得电子数:6-4=2,该反应中转移电子数是2,用双线桥标出该反应电子转移的方向和数目为: 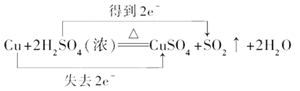 ,正确答案
,正确答案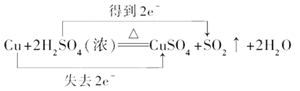 。
。
③该反应中有一半的硫酸是氧化剂,一半的硫酸起酸的作用,所以若有![]() 的
的![]() 参与反应,则被还原的
参与反应,则被还原的![]() 的物质的量是
的物质的量是![]() ,由此可以知道生成标况下的二氧化硫气体的体积为
,由此可以知道生成标况下的二氧化硫气体的体积为![]() ;该反应转移电子2mol电子,消耗浓硫酸2mol,现
;该反应转移电子2mol电子,消耗浓硫酸2mol,现![]() 的
的![]() 参与反应,转移电子2.4 mol,电子的数目为2.4NA 或1.4448×1024;正确答案:26.88L; 2.4NA (或者1.4448×1024)。
参与反应,转移电子2.4 mol,电子的数目为2.4NA 或1.4448×1024;正确答案:26.88L; 2.4NA (或者1.4448×1024)。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | 蒸馏 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | Ca(OH)2 | 盐酸,过滤 |
A. A B. B C. C D. D
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
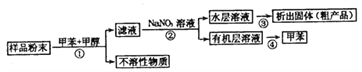
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D