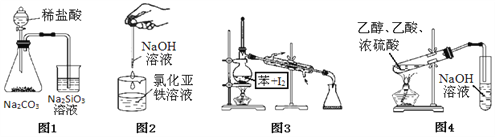
��Ŀ����
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء�E��ͬ����Ԫ�ؽ�������ǿ��Ԫ�ء��ס��ҡ�����������������������Ԫ���е����ֻ�����ɵĻ�������ǵ�ת����ϵ��ͼ��ʾ�����м��������еĵ�ζƷ�����ǵ���ɫ���塣����˵������ȷ����
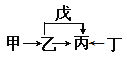
A. ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��r(E)>r(F)>r(C)>r(D)
B. Ԫ��F���������ˮ�ﻯ������һ������������ǿ
C. Ԫ��B���⻯����ܾ�����������ṹ
D. ������A4BC2D�ȿ����ǹ��ۻ����Ҳ�������ӻ�����
���𰸡�B
��������A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء�E��ͬ����Ԫ�ؽ�������ǿ��Ԫ�أ���EΪ��Ԫ�أ���������ͼ�Ƶ����Ҽ��������еĵ�ζƷ�����ǵ���ɫ���壬��֪��Ϊ�Ȼ��ƣ���Ϊ�������ƣ����Ϊ̼���ƣ���Ϊ�������ƣ����Ƕ�����̼����A��B��C��D��E��F�ֱ�ΪH��C��N��O��Na��Cl��A. ͬ������Ԫ�ش�����ԭ�Ӱ뾶��С��ͬ����Ԫ�ش��϶���ԭ�Ӱ뾶������ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��r(Na)>r(Cl)>r(N)>r(O)��ѡ��A��ȷ��B. Ԫ��Cl������������ˮ�ﻯ������һ������������ǿ������������������ˮ�������ܱȽ�������HClO�����ᣬѡ��B����ȷ��C. Ԫ��B���⻯��CH4������������ṹ��ѡ��C��ȷ��D. ������A4BC2D�ȿ����ǹ��ۻ�����CO(NH2)2��Ҳ�������ӻ�����NH4CNO��ѡ��D��ȷ����ѡB��
�����͡���ѡ��
��������
6
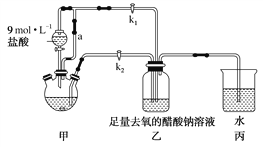
����Ŀ����ͼ��ʾװ�ÿɼ��������ҵ��ˮ�к������ӣ�NH4+��������˵������ȷ����

A. ���ǵ���ת��Ϊ��ѧ�ܵ�װ��
B. ������������ʱ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. ������H2��N2�����ʵ���֮��Ϊ3:1���������ˮ��pH��С
D. ��ع���ʱ���׳��е�Na������Mg�缫
���𰸡�D
��������A�����л��ý���þ��ԭ��صĸ�����ʯīΪ�����γ�ԭ��أ���������ԭ��صĵ��أ�������Թ�ҵ��ˮ�������ǽ�����ת��Ϊ��ѧ�ܵ�װ�ã�ѡ��A��ȷ��B�����������º�����������ʱת��Ϊ��������Ӧ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+��ѡ��B��ȷ��C��������H2��N2�����ʵ���֮��Ϊ3:1�����ݵ缫��Ӧ6H++6e-=3H2����3Cl2 + 2NH4+=N2 + 6Cl-+8H+���������ˮ��H+Ũ������pH��С��ѡ��C��ȷ��D����ع���ʱ���׳���ԭ��أ�ԭ�����������Na����������ʯī�缫��ѡ��D����ȷ����ѡD��