题目内容
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,工艺流程如下 :
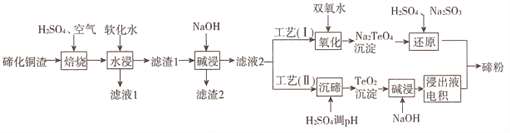
(1)“焙烧”后,碲主要以TeO2 形式存在,写出相应反应的化学方程式:_____________。
(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
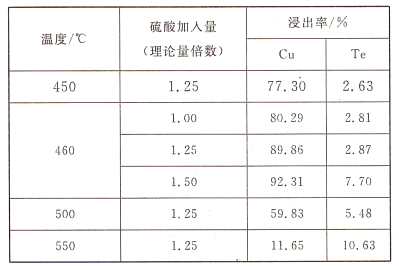
则实验中应选择的条件为_______________,原因为_______________。
(3)工艺( I)中,“还原”时发生的总的化学方程式为_______________。
(4)由于工艺(I)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(II)获得碲。则“电积”过程中,阴极的电极反应式为_______________。
(5)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合并,进入铜电积系统。该处理措施的优点为________________。
②滤渣3中若含Au和Ag,可用__________将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
【答案】 Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O 460℃、硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O TeO32-+4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
2CuSO4+TeO2+2H2O 460℃、硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O TeO32-+4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
【解析】流程分析:流程的目的为从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,则要先除杂。步骤1,培烧Cu2Te,通入氧气将Cu2Te氧化;步骤2,水浸,根据流程可知Te元素进入滤渣1,CuSO4进入滤液1,Cu和Te分离。可推断,步骤1中Cu被氧化为CuO后被硫酸溶解,生成易溶于水的硫酸铜,而Te以微溶于水的TeO2形式存在。步骤3,碱浸,Te元素进入滤液2,则TeO2与NaOH反应生成易溶于水的盐。
(1)碲(Te)为第VIA元素,则Te最低化合价为-2价,所以Cu2Te中Cu为+1价,Te为-2价。培烧时通入空气,加入硫酸,生成物中Te主要以TeO2形式存在,Te被氧化为+4价,Cu被氧化为+2价,根据元素守恒,硫酸将Cu溶解生成硫酸铜。利用化合价升降守恒可配平得方程式为:Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O。
2CuSO4+TeO2+2H2O。
故答案为:Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O;
2CuSO4+TeO2+2H2O;
(2)培烧的主要目的为将Cu元素转变为易溶于水CuSO4的,将Te元素转变为微溶于水的TeO2,从而达到分离Cu与Te的目的。所以培烧加硫酸的过程中,应提高Cu的浸出率,降低Te的浸出。分析表格数据可知,当硫酸的量一定时,温度升高,铜的浸出率降低;温度一定时,铜和Te的浸出率均增大。“460℃、硫酸用量为理论量的1.25倍”的条件最佳,因为该条件下,铜的浸出率高且碲的损失较低。
故答案为:460℃、硫酸用量为理论量的1.25倍;该条件下,铜的浸出率高且碲的损失较低。
(3)碲(Te)为第VIA元素,可以类比S元素进行解题。类比SO2与NaOH的反应可知,碱浸过程中发生的反应为:TeO2+2NaOH= Na2TeO3+H2O。工艺(I)中,加入双氧水,Na2TeO3被氧化为Na2TeO4沉淀。再加入Na2SO3,Na2TeO4被还原为Te单质。还原过程的方程式为:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O。
故答案为:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O;
(4)工艺(II)中,浸出液主要溶质为Na2TeO3,阴极得电子,化合价降低,被还原,则阴极反应为:TeO32-+4e-+3H2O=Te+6OH-。
故答案为:TeO32-+4e-+3H2O=Te+6OH-。
(5)①培烧、水浸后滤渣2中还有未浸出的铜,再次加硫酸溶解后得到硫酸铜,过滤后滤液3中主要成分为硫酸铜,与滤液1中的硫酸铜合并,进入铜电积系统,提取铜,该措施有效回收利用了硫酸铜,提高了经济效益;②Au和Ag都能溶于王水,不能用王水分离银、金;Ag溶于稀硝酸,Au不溶于硝酸,可以将二者分离;浓NaOH、浓盐盐酸都不与Ag、Au反应,不能将金、银分离。
故答案为:CuSO4溶液回收利用,提高经济效益;B。