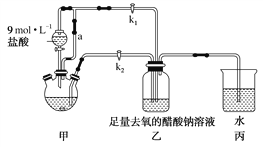
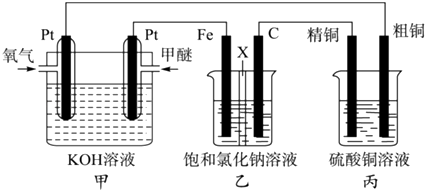
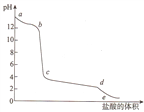
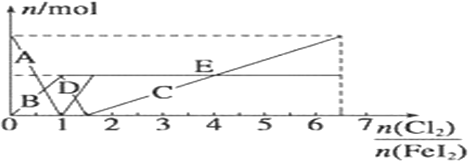
��Ŀ����
����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
������һ�ַϷ��������չ���·�ߣ�
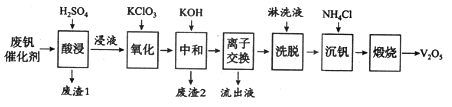
�ش��������⣺
��1��������������һ�ִ������ɽ�SO2ת��ΪSO3����д���÷�Ӧ�Ļ�ѧ����ʽ____________��
��2���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪ_________________________��ͬʱV2O4ת��VO2+��������1������Ҫ�ɷ���_____________��
��3��������������ʹ3 mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ______mol��
��4�����к͡�����֮һ��ʹ����V4O124����ʽ��������Һ�С�������2���к���_______��
��5��������Һ����������������________��
��6�����������õ�ƫ����泥�NH4VO3��������д�������ա��з�����Ӧ�Ļ�ѧ����ʽ____________��
���𰸡� 2SO2+O2 ![]() 2SO3 V2O5��2H��=2VO2����H2O SiO2 0.5 Fe(OH)3��Al(OH)3 K�� 2NH4VO3
2SO3 V2O5��2H��=2VO2����H2O SiO2 0.5 Fe(OH)3��Al(OH)3 K�� 2NH4VO3![]() V2O5��H2O��2NH3��
V2O5��H2O��2NH3��
���������ӷϷ������л���V2O5�������̿�֪���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+������������������ת��Ϊ���������ӣ�ֻ��SiO2���ܣ�����˵õ�������1ΪSiO2��Ȼ���������KClO3����VO2+��ΪVO2+���ټ�KOHʱ�������ӡ�������ת��ΪFe(OH)3��Al(OH)3������ͬʱ�к����ᣬ���˵õ�������2ΪFe(OH)3��Al(OH)3��ͬʱʹ����V4O124����ʽ��������Һ�У������ӽ���������ϴ�����ɼ�ʾΪ��4ROH+V4O124-![]() R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ�����(NH4VO3)��������������ʱ�ֽ�����V2O5��
R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ�����(NH4VO3)��������������ʱ�ֽ�����V2O5��
(1)������������һ�ִ������ɽ�SO2ת��ΪSO3����Ӧ�Ļ�ѧ����ʽΪ2SO2+O2 ![]() 2SO3���ʴ�Ϊ��2SO2+O2
2SO3���ʴ�Ϊ��2SO2+O2 ![]() 2SO3��
2SO3��
(2)�������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪV2O5+2H+=2VO2++H2O��������������֪����1ΪSiO2���ʴ�Ϊ��V2O5+2H+=2VO2++H2O��SiO2��
(3)������������ʹ3 mol��VO2+��ΪVO2+���ɵ����غ��֪������Ҫ������KClO3����Ϊ![]() =0.5mol���ʴ�Ϊ��0.5��
=0.5mol���ʴ�Ϊ��0.5��
(4)����������������֪����2ΪFe(OH)3��Al(OH)3���ʴ�Ϊ��Fe(OH)3��Al(OH)3��
(5)������������֪������Һ����ҪΪ����أ���������Һ����������������K+���ʴ�Ϊ��K+��
(6)���������з�����Ӧ�Ļ�ѧ����ʽΪ2NH4VO3![]() V2O5+H2O��+2NH3�����ʴ�Ϊ��2NH4VO3
V2O5+H2O��+2NH3�����ʴ�Ϊ��2NH4VO3![]() V2O5+H2O��+2NH3����
V2O5+H2O��+2NH3����