题目内容
5.一定条件下,在体积为3L的密闭容器中反应:CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(1)根据如图1,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是$\frac{2{n}_{B}}{{3t}_{B}}$mol/(L•min)(用nB、tB表示).
(3)该可逆反应达到化学平衡状态的标志是ac(填字母).
a、CO、H2、CH3OH的浓度均不再变化 b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变 d、v生成(CH3OH)=v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是cd(填字母).
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/c(CH3OH)减小
(5)根据题目有关信息,请在如图2坐标图中标示出该化学反应过程的能量变化(标明信息).
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该电池中负极上的电极反应式是:
2CH3OH-12e-+16OH-=2CO32-+12H2O,则正极上发生的电极反应为:O2+2H2O+e-=4OH-.
分析 (1)从平衡移动角度结合K表达式分析;
(2)用v=$\frac{△c}{△t}$求算;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;(4)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
(5)根据该反应放热,生成物的总能量小于反应物的总能量,△H<O;
(6)根据正极的电极反应=总反应-负极的电极反应.
解答 解:(1)500℃时,生成物的浓度比300℃低,说明升温平衡逆向移动,其△H<0,升温时平衡逆向移动,K减小;
故答案为:减小;
(2)生成甲醇nBmol,则参加反应的氢气2nBmol,v(H2)=$\frac{2{n}_{B}}{{3t}_{B}}$mol/(L•min),故答案为:$\frac{2{n}_{B}}{{3t}_{B}}$mol/(L•min);
(3)化学平衡状态判断的关键:v(正)=v(逆)和各物质的浓度保持不变.
a、物质的浓度保持不变说明反应已达平衡状态,故a正确;
b、V是3L不变,反应物和生成物都是气体,混合气体总质量m不变,所以ρ时刻保持不变,故b错误;
c、反应物有3mol气体时完全反应后应生成1mol气体,气体物质的量减小,质量不变,故平均相对分子质量不变时说明反应已达平衡状态,故c正确.
d、v生成(CH3OH)和v消耗(CO)都是正向进行,无法体现v(正)=v(逆),故d错误;
故答案为:ac;
(4)a.将容器的容积压缩到原来的$\frac{1}{2}$,氢气的物质的量减少,但c(H2)增大,故错误;
b.将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正逆反应速率都增大,故b错误;
c.将容器的容积压缩到原来的$\frac{1}{2}$,平衡向正反应方向移动,CH3OH 的物质的量增加,故c正确;
d.将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,故d正确;
故答案为:cd;
(5)该反应放热,生成物的总能量小于反应物的总能量,△H<O,图象为: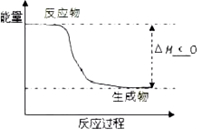 ;
;
故答案为: ;
;
(6)燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,负极上的电极反应式是:2CH3OH-12e-+16OH-=2CO32-+12H2O,两式相减,正极上的电极反应式是:O2+2H2O+e-=4OH-;
故答案为:O2+2H2O+e-=4OH-.
点评 本题主要考查化学反应速率、平衡图象、化学平衡常数、平衡状态的判断、电极反应方程式等,难度不大,注意基础知识的理解掌握.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因:反应中生成的锰离子具有催化作用,所以随后褪色会加快.当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色由无色变成紫红色,且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
| A. | 2 | B. | 2.3 | C. | 11.7 | D. | 12 |
| A. | BaCl2溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | Ba(OH)2溶液 |
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| C. | 反应热的大小只与反应体系的始态和终态有关 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |