题目内容
16.25℃时,0.005mol/L氢氧化钡溶液的pH是( )| A. | 2 | B. | 2.3 | C. | 11.7 | D. | 12 |
分析 pH=-lgC(H+),碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算.
解答 解:0.005mol/LBa(OH)2溶液中氢氧根离子浓度=0.005 mol/L×2=0.01mol/L,根据离子积常数KW=c(H+)•c(OH-),知,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH=12,
故选D.
点评 本题考查了pH的有关计算,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.下列物质在生活中应用时,起还原作用的是( )
| A. | 食醋除水垢 | B. | 硅胶作干燥剂 | ||
| C. | 漂白粉漂白织物 | D. | 铁粉作食品袋内的脱氧剂 |
7.下列实验能达到实验目的是( )
| A. | 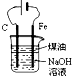 制备 Fe(OH)2 并能较 长时间观察其颜色 | |
| B. | 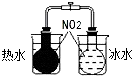 探究温度对平衡移动的影响 | |
| C. | 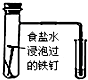 验证铁发生析氢腐蚀 | |
| D. | 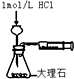 测定反应速率 |
4.要使含有盐酸的氯化钡溶液中和至中性,在不用指示剂的条件下,最好加入下列物质中的( )
| A. | 氨水 | B. | 氢氧化钡 | C. | 纯碱 | D. | 碳酸钡 |
11.不属于石油分馏产品的是( )
| A. | 石蜡 | B. | 乙烯 | C. | 汽油 | D. | 煤油 |
8.下列关于浓硫酸的叙述,正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |
6.某气态烃1mol跟2mol氯化氢加成,其加成产物又可被8mol氯气完全取代,该烃可能是( )
| A. | 丙烯 | B. | 乙烯 | C. | 2-丁炔 | D. | 丙炔 |
