题目内容
14.有人以化学反应:2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则原电池的负极发生的电极反应为2Zn-4e-═2Zn2+.分析 根据电池反应式知,锌失电子发生氧化反应而作负极.
解答 解:根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为2Zn-4e-═2Zn2+,故答案为:2Zn-4e-═2Zn2+.
点评 本题考查了原电池原理,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.

练习册系列答案
相关题目
4.要使含有盐酸的氯化钡溶液中和至中性,在不用指示剂的条件下,最好加入下列物质中的( )
| A. | 氨水 | B. | 氢氧化钡 | C. | 纯碱 | D. | 碳酸钡 |
2.某有机物的结构如图所示,下列说法正确的是( )
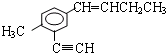

| A. | 与乙苯互为同系物 | |
| B. | 分子中共直线的原子最多有4个 | |
| C. | 分子中共平面的碳原子最多有12个 | |
| D. | 与其互为同分异构体且萘环上只有一个侧链的共有4种 |
9.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3g金属钠全部变成钠离子时失去的电子数目为0.2NA | |
| B. | 2g氢气所含原子数目为NA | |
| C. | 17gNH3 所含的分子数为10NA | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
19.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| B. | 11.2 L NH3中所含的原子数为2NA | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
6.某气态烃1mol跟2mol氯化氢加成,其加成产物又可被8mol氯气完全取代,该烃可能是( )
| A. | 丙烯 | B. | 乙烯 | C. | 2-丁炔 | D. | 丙炔 |

