题目内容
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
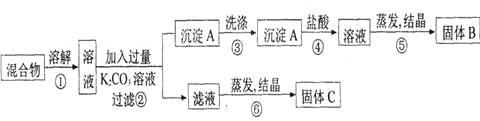
(1)B物质的化学式为_____________________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是_______(填序号)改进措施是__________________________。
(3)写出K2CO3的电离方程式_________________________________________________。
(4)写出②④两步中对应的离子方程式:
②_______________________________________________________________
④_______________________________________________________________
【答案】BaCl2 ⑥ 在步骤⑥蒸发结晶之前向滤液中滴加盐酸至不再冒气泡( K2CO3 =2K++CO32- Ba2++CO32-= BaCO3↓ BaCO3+2H+=Ba2+CO2↑+H2O
【解析】
混合物溶解所得溶液中加入K2CO3过滤得沉淀A为BaCO3,滤液为KCl和过量的K2CO3的混合液,蒸发结晶得固体C为KCl ,此过程应用适量的HCl除去过量的K2CO3,沉淀A用盐酸溶解得BaCl2溶液,蒸发结晶得固体B为BaCl2。
(1)从以上分析可知,B为BaCl2溶液,故答案为BaCl2;
(2)KCl和BaCl2的混合液中加入过量的K2CO3溶液后,得到沉淀BaCO3和滤液KCl和过量的K2CO3的混合液,直接蒸发结晶,得到的KCl中会混有K2CO3,所以在步骤⑥蒸发结晶之前向滤液中滴加盐酸至不再冒气泡以除去K2CO3,故答案为:⑥,步骤⑥蒸发结晶之前向滤液中滴加盐酸至不再冒气泡;
(3)K2CO3是强电解质,完全电离,其电离方程式为:K2CO3 =2K++CO32-;
(4)第②步反应是BaCl2和K2CO3反应:Ba2++CO32-= BaCO3↓;第④步是BaCO3和HCl反应:BaCO3+2H+=Ba2+CO2↑+H2O。