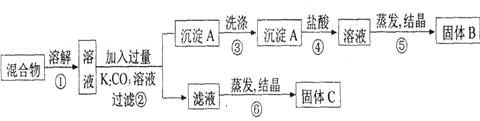
题目内容
【题目】一定量氢气在氯气中燃烧,所得混合物用![]() 溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比![]() ________。
________。
【答案】![]() 、
、![]() 0.250
0.250 ![]()
【解析】
由溶液中含有0.0500 mol次氯酸钠可知,氢气在氯气中燃烧时,氯气过量,反应得到氯化氢和氯气的混合气体。
(1)氯化氢和氯气的混合气体被氢氧化钠溶液吸收时,氯化氢与氢氧化钠溶液发生中和反应生成氯化钠和水,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O,故答案为:OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O;
(2)根据溶液电中性原则可知:n(Na+)=n(Cl-)+n(ClO-),n(Cl-)=n(Na+)-n(ClO-)=0.1L×3.00mol/L-0.0500mol=0.250mol,则所得溶液中NaCl的物质的量为0.250mol,故答案为:0.250;
(3)根据Cl原子守恒可知,n(Cl2)=![]() ×n(NaOH)=0.15mol,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol次氯酸钠消耗过量氯气0.0500 mol,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol,氢气在氯气中燃烧的化学方程式为H2+Cl2
×n(NaOH)=0.15mol,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol次氯酸钠消耗过量氯气0.0500 mol,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol,氢气在氯气中燃烧的化学方程式为H2+Cl2![]() 2HCl,由化学方程式可知氢气的物质的量为0.1mol,故氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,故答案为:3:2。
2HCl,由化学方程式可知氢气的物质的量为0.1mol,故氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,故答案为:3:2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
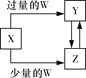
选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D