题目内容
【题目】为测定某含有杂质Na2O的Na2O2样品的纯度,3个小组分别设计如下方案。首先准确称量样品m g,然后,按照以下方案进行实验,请你完成相关内容:
[方案一](1)将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为n g,通过计算求出试样中Na2O2的含量。Na2O2与水反应的离子方程式是______________;根据所给数据计算出试样中Na2O2含量的代数式为____________。
[方案二]将样品与二氧化碳反应,通过测定反应产生氧气的体积(体积可转化成质量),计算出样品中Na2O2的含量。
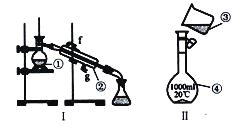
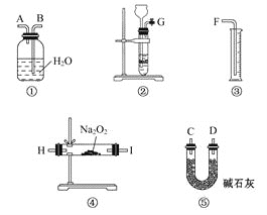
(2)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接顺序是_______。(填写仪器编号)
(3)装置①⑤的作用分别是:
①___________________;
⑤____________________________。
【答案】2Na2O2+2H2O=4Na++4OH-+O2↑ ![]() ×100% ②④⑤①③ 排水法收集O2 除去O2中混有的CO2气体
×100% ②④⑤①③ 排水法收集O2 除去O2中混有的CO2气体
【解析】
本题的实验目的是定某含有杂质Na2O的Na2O2样品的纯度,其两种方案的原理是根据Na2O2的性质,让其产生O2,并测量O2的量,从而计算Na2O2的纯度。
(1)方案一中,仅Na2O2遇水反应产生O2,其离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;该方案中,还涉及的反应有![]() ,m(CuO)=n g,则n(CuO)=
,m(CuO)=n g,则n(CuO)=![]() =
=![]() mol,由于2Na2O2-O2-2CuO,故n(Na2O2)=
mol,由于2Na2O2-O2-2CuO,故n(Na2O2)=![]() mol,m(Na2O2)=
mol,m(Na2O2)=![]() mol×78g/mol=
mol×78g/mol=![]() g,w(Na2O2)=
g,w(Na2O2)=![]() =
= ![]() ×100%;
×100%;
(2)方案二中,仅Na2O2遇CO2反应产生O2,该实验装置中,②为CO2的发生装置,④为CO2和Na2O2的反应装置,在该装置中,CO2不能完全参加反应,未反应的CO2会和O2一起进入下一个装置中,为了避免对O2体积的测定产生干扰,需要用⑤来除去这部分未反应的CO2,①③为O2气体体积的测定装置,故装置的连接顺序为②④⑤①③;
(3)①的作用是用排水法收集O2;⑤的作用是除去O2中混有的CO2气体。

【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
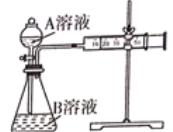
(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
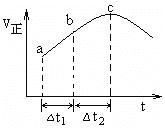
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
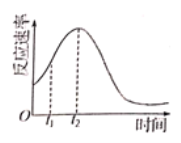
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。