题目内容
【题目】工业上处理含苯酚废水的过程如下。回答下列问题:
Ⅰ.测定废水中苯酚的含量。
测定原理:![]() +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr
测定步骤:
步骤1:准确量取![]() 待测废水于
待测废水于![]() 锥形瓶中。
锥形瓶中。
步骤2:将![]()
![]() 浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入![]()
![]()
![]() 溶液(过量),塞紧瓶塞,振荡。
溶液(过量),塞紧瓶塞,振荡。
步骤4:滴入2~3滴指示剂,再用![]()
![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 溶液
溶液![]() (反应原理:
(反应原理:![]() )。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗
)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗![]() 溶液
溶液![]() 。
。
(1)“步骤1”量取待测废水所用仪器是________。
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和________。
(3)“步骤4”滴定终点的现象为________。
(4)该废水中苯酚的含量为________![]() (用含
(用含![]() 、
、![]() 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量________(填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量________。
的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量________(填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量________。
Ⅱ.处理废水。采用![]() 基
基![]() 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·
为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·![]() ),阴极上产生
),阴极上产生![]() 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为
。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为![]() 和
和![]() 。
。
(5)写出阳极的电极反应式:________。
(6)写出苯酚在阴极附近被![]() 深度氧化的化学方程式:________。
深度氧化的化学方程式:________。
【答案】(酸式)滴定管 塞紧瓶塞 滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色 ![]() 偏低 偏低
偏低 偏低 ![]()
![]()
【解析】
向呈有待测废水加入浓溴水反应后得到三溴苯酚的沉淀,再加入KI溶液与剩下的Br2发生氧化还原反应得到I2,方程式为Br2+2I-===I2+2Br-,再用Na2S2O3标准溶液滴定I2,可根据消耗的Na2S2O3标准溶液的体积和浓度算出溶液中剩余的Br2的物质的量,再设置一个空白实验测出浓溴水的物质的量,用Br2总的物质的量-剩余Br2的物质的量即可得出与苯酚反应的Br2的物质的量,再结合反应方程式得到苯酚的物质的量,从而求出废水中苯酚的含量,结合实验基本操作及注意事项解答问题。
(1)由于苯酚显酸性,因此含苯酚的废水为酸性,“步骤1”中准确量取废水时所用的仪器可选用酸式滴定管,故答案为:酸式滴定管;
(2)由于溴单质易挥发,因此可采用塞进瓶塞、迅速加入试剂等方法防止其挥发,故答案为:塞紧瓶塞;
(3)用0.01mol/LNa2S2O3标准溶液滴定至终点,由于Na2S2O3标准溶液会反应I2,加入的淀粉遇I2变成蓝色,所以滴定终点的现象为滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色,故答案为:滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色;
(4)根据反应方程式可得各物质的物质的量关系式:
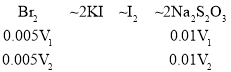
剩下的浓溴水中Br2的物质的量为0.005V1 mmol,将待测废液换成蒸馏水时,5mL amol/L的浓溴水中Br2的物质的量为0.005V2 mmol,则与苯酚参与反应的Br2的物质的量为0.005(V2-V1) mmol,根据方程式![]() +3Br2→
+3Br2→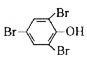 ↓+3HBr可得苯酚的物质的量为
↓+3HBr可得苯酚的物质的量为![]() mmol,质量为
mmol,质量为![]() mg,则该废水中苯酚的含量为
mg,则该废水中苯酚的含量为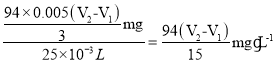 ,若步骤2中忘记塞进瓶塞,溴单质挥发,导致最终消耗的Na2S2O3的体积偏小,则测得苯酚的含量偏低,如果空白实验中步骤4滴定终点时俯视读数,读得的体积偏小,则消耗的Na2S2O3的体积偏小,使测得苯酚的含量偏低,故答案为:
,若步骤2中忘记塞进瓶塞,溴单质挥发,导致最终消耗的Na2S2O3的体积偏小,则测得苯酚的含量偏低,如果空白实验中步骤4滴定终点时俯视读数,读得的体积偏小,则消耗的Na2S2O3的体积偏小,使测得苯酚的含量偏低,故答案为:![]() ;偏低;偏低;
;偏低;偏低;
(5)由题干信息可知,Ti基PbO2为阳极,则阳极H2O失去电子产生·OH,电极反应式为H2O-e-===H++·OH,故答案为:H2O-e-===H++·OH;
(6)根据题干信息可知,苯酚被阴极产生的H2O2深度氧化产生CO2和H2O,有氧化还原反应规律得到其反应方程式式为C6H5OH+14H2O2===6CO2↑+17H2O,故答案为:C6H5OH+14H2O2===6CO2↑+17H2O。

 字词句段篇系列答案
字词句段篇系列答案【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJmol-1
CH3OH(g) △H1=-99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:CH3OH结构式
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=____________。
(2)关于反应①下列说法,正确的是____________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:

①从反应开始到5min时,生成甲醇的平均速率为____________。
②H2的平衡转化率α=____________%,化学平衡常数K=____________。
③1min时,υ正____________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正____________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小____________。
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数____________0.1(填“>”、“<”或“=”)。