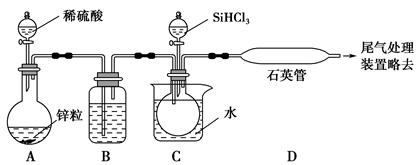
题目内容
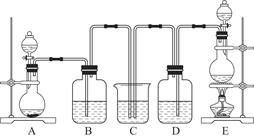
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。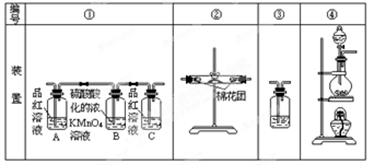
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2)④②①③
CO2↑+2SO2↑+2H2O (2)④②①③
(3)除去SO2;A中品红溶液褪色;CO2+Ca2++2OH-=H2O+CaCO3↓
(4)由白色变为蓝色
解析试题分析:(1)浓硫酸具有强氧化性,在加热的条件下与木炭发生反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(2)浓硫酸与木炭共热化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
(3)根据以上分析可知B瓶溶液的作用是除去SO2;本实验中能说明二氧化硫具有漂白性的实验现象是A中品红溶液褪色;③中反应的离子方程式为CO2+Ca2++2OH-=H2O+CaCO3↓。
(4)硫酸铜吸水变为胆矾,则装置②中所盛是无水硫酸铜,现象是由白色变为蓝色,
考点:考查浓硫酸与木炭反应产物检验的实验方案设计

 课堂全解字词句段篇章系列答案
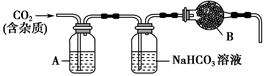
课堂全解字词句段篇章系列答案某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。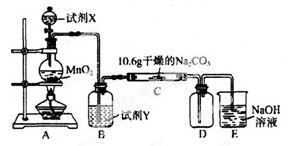
(1)写出装置A中发生反应的离子方程式: 。
(2)写出试剂Y的名称_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分:NaHCO3和__________
假设二:存在三种成分:NaHCO3和__________、__________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加_________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加________: | 若溶液变浑浊,结合步骤2中的①,则假设一成立:结合步骤2中的②,则假设二成立。 |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=____ (用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有___________。
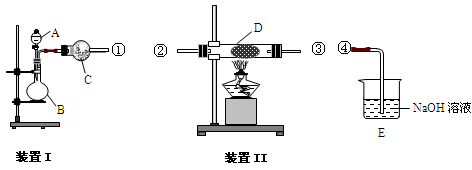
(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。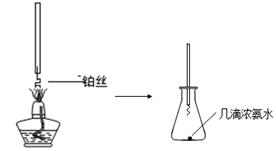
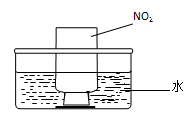
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |


 SiHCl3+H2);
SiHCl3+H2);