题目内容
实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。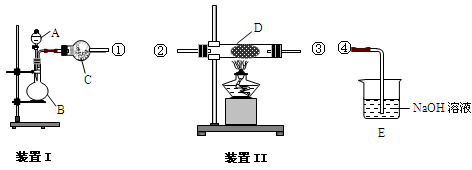
请回答下列问题:
(1)①仪器A的名称是 ,仪器B中应加入的固体药品 (填化学式);
②实验中观察到D内红棕色气体的化学式为 ,证明氨气具有 性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为 ;
②此时仪器C中改为盛装P2O5 的作用是 。
(1)①分液漏斗; Na2O2 ; ②NO2 ; 还原性
(2)①Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑②干燥SO2气体
解析试题分析:(1)①根据题意,装置Ⅰ中产生的是氨气和氧气,所以可以加入Na2O2固体;②含氮的化合物只有NO2为红棕色气体,氨气被氧化为二氧化氮,所以氨气表现了还原性 ;(2)①根据强酸制弱酸的原理,反应为:Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑②P2O5通常用作酸性干燥剂。
考点:考查实验基础,气体的制备。

(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。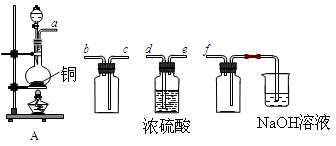
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
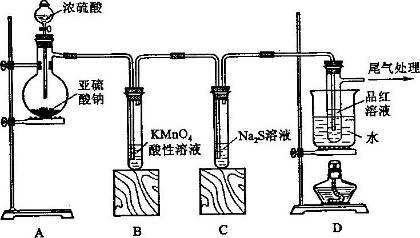
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: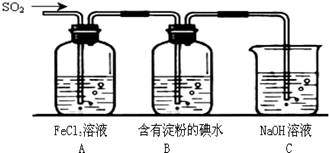
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是______,原因是___________________________________。
(5)能表明的还原性性弱于SO2的现象是________________________________________。
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。
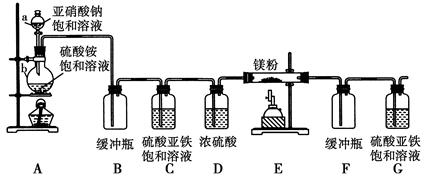
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。
(一)常用下列途径制备海波:
已知反应:4FeS+7O2  2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3
(1)计算原料FeS在反应(a)和(b)中的理论分配比:_________。
(2)现有88gFeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为____克(精确到0.1克)
(二)工业上制得的海波晶体中可能含有少量的亚硫酸钠和硫酸钠杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后过滤出硫,微热滤液使生成的SO2全部逸出(Na2S2O3+ H2SO4® Na2SO4+ SO2↑+ S↓+ H2O)。测得有关实验数据如下(标准状况):
| | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
(3)计算所用硫酸溶液的物质的量浓度。(写出计算过程)
(4)分析以上实验数据,可判断该样品__________(填字母)
A.不含Na2SO3和Na2SO4 B.不含Na2SO3 含Na2SO4
C.含Na2SO3不含Na2SO4 D.含Na2SO3和Na2SO4
(5)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积______(aL)在不同取值范围时,生成SO2体积___________(bL,标态)的值。(可用含a和b的代数式表示)
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |

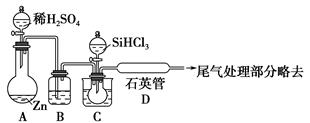
 SiHCl3+H2
SiHCl3+H2