题目内容
15.在下列反应中,生成物的能量总和高于反应物的能量总和且表述正确的是( )| A. | Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2↑(g)△H<0 | B. | 2CO(g)+O2(g)═2CO2(g)△H<0 | ||
| C. | C(s)+CO2(g)═2 CO(g)△H>0 | D. | H+(aq)+OH-(aq)═H2O (l)△H>0 |
分析 生成物的能量总和高于反应物的能量总和,则该反应为吸热反应,常见的吸热反应:1.大多数的分解反应 2.工业制水煤气;3.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO;4.铵盐与碱反应:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;据此判断.
解答 解:A.金属与酸反应是放热反应,则Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2↑(g)△H<0,故A错误;
B.燃烧反应是放热反应,则2CO(g)+O2(g)═2CO2(g)△H<0,故B错误;
C.碳与二氧化碳反应是吸热反应,则C(s)+CO2(g)═2 CO(g)△H>0,故C正确;
D.酸与碱反应是放热反应,则H+(aq)+OH-(aq)═H2O (l)△H<0,故D错误.
故选C.
点评 本题主要考查化学反应中能量转化,注意生成物的能量总和高于反应物的能量总和,则该反应为吸热反应,掌握常见的吸热反应和放热反应即可.

练习册系列答案
相关题目
5.下列各反应中,生成物不随反应条件或反应物用量的变化而变化的是( )
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |
10.海水中含有丰富的镁资源.锂(Li)与镁元素性质相似.
(1)某同学设计了从模拟海水中制备MgO的实验方案:
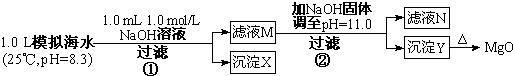
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12
请回答:沉淀物X为CaCO3(写化学式);滤液N中存在的金属阳离子为Ca2+、Na+,;
步骤②中若改为加入 4.2gNaOH固体,沉淀物Y为Mg(OH)2(写化学式).
(2)物质的量为0.10mol的锂在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是0.7g<m<1.5g;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则放电时电池的正极反应为CoO2+Li++e-=LiCoO2.
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂.
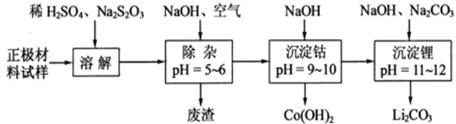
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4.
②调整PH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
(1)某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12
请回答:沉淀物X为CaCO3(写化学式);滤液N中存在的金属阳离子为Ca2+、Na+,;
步骤②中若改为加入 4.2gNaOH固体,沉淀物Y为Mg(OH)2(写化学式).
(2)物质的量为0.10mol的锂在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是0.7g<m<1.5g;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则放电时电池的正极反应为CoO2+Li++e-=LiCoO2.
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂.

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4.
②调整PH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
7.NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 7.8g过氧化钠晶体中含有0.1NA个O${\;}_{2}^{2-}$ | |
| C. | 标准状况下,22.4LNO2中含有NA个NO2分子 | |
| D. | 1mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$的数目小于NA |
5.如图所示与对应的叙述相符的是( )
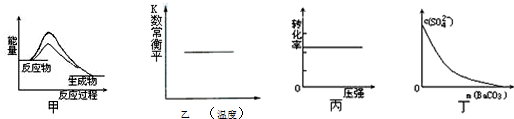

| A. | 图甲表示使用催化剂后,该反应的△H变小 | |
| B. | 图乙表示反应NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1反应的平衡常数随温度的变化 | |
| C. | 图丙表示反应H2(g)+I2(g)?2HI(g)中H2的转化率随压强的变化 | |
| D. | 图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(${SO}_{4}^{2-}$)的浓度变化 |
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: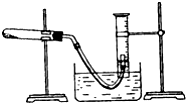 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下: