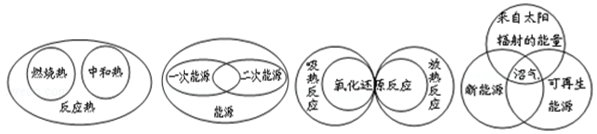
题目内容
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
D
解析试题分析:A、根据题给热化学方程式知,2mol(g)和1mol O2(g)完全反应生成2mol H2O(g),放热270kJ,则逆反应吸热270kJ,2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量,正确;B、2mol(g)和1mol O2(g)完全反应生成2mol H2O(g),放热270kJ,气态水变化为液体放热,2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ,正确;C、反应是放热反应,反应物能量总和大于生成物能量总和,故2mol氢气与1mol氧气的能量总和大于2mol气态水的能量,正确;D、热化学方程式中化学方程式计量数只表示物质的量不表示微粒个数,错误。
考点:考查化学反应与能量变化、热化学方程式的意义。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案已知2H2(g)+O2(g)= 2H2O(l) ΔH=-569.6 kJ·mol-1, 2H2O(g)= 2H2(g)+O2(g) ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43 kJ | B.4.86 kJ | C.43.8 kJ | D.87.5 kJ |
下列说法不正确的是
| A.钠与乙醇反应,钠块沉在乙醇液面下面 |
| B.除去乙酸乙酯中残留的乙酸,可用饱和Na2CO3溶液洗涤后分液 |
| C.伴有能量变化的物质变化都是化学变化 |
| D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
下列说法正确的是:
A.在100℃、101kPa条件下,液态水的气化热为40. 69 kJ·mol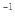 ,则 ,则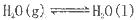  |
B.已知MgCO3的Ksp=6.82×10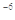 ,则所有含有固体MgCO3的溶液中,都有 ,则所有含有固体MgCO3的溶液中,都有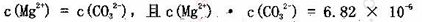 |
C.己知: 则可以计算出反应 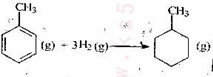  |
D.常温下,在0.10mol 的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的PH减小 的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的PH减小 |
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
| A.Na+(g)+Cl-(g)===NaCl(s) ΔH | B.Na(s)+ Cl2(g)===NaCl(s) ΔH1 Cl2(g)===NaCl(s) ΔH1 |
| C.Na(g)-e-===Na+(g) ΔH2 | D.Cl(g)+e-===Cl-(g) ΔH3 |
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
| A.天然气、石油、流水、风力、氢气为一级能源 |
| B.无论是风力发电还是火力发电,都是将化学能转化为电能 |
| C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
| D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 |
下列变化为放热的化学反应的是 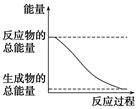
| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如右图所示的化学反应 |
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g) ===2H2O(g) ΔH=-Q2 ②
H2O(g) ===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为 ( )
| A.4Q1+0.5Q2+9Q3 | B.4Q1+0.5Q2 | C.4Q1+Q2+10Q3 | D.4Q1+2Q2 |