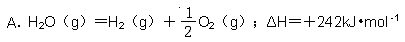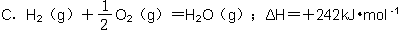题目内容
下列说法不正确的是
| A.钠与乙醇反应,钠块沉在乙醇液面下面 |
| B.除去乙酸乙酯中残留的乙酸,可用饱和Na2CO3溶液洗涤后分液 |
| C.伴有能量变化的物质变化都是化学变化 |
| D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
C
解析试题分析:A.钠与乙醇反应,因为Na的密度比乙醇大,所以钠块沉在乙醇液面下面,正确;B.因为乙酸能够与Na2CO3发生反应,而且乙酸乙酯在饱和Na2CO3溶液中难溶,密度比水小,所以除去乙酸乙酯中残留的乙酸,可用饱和Na2CO3溶液洗涤后分液,正确;C.伴有能量变化的物质变化可能是物理变化,也可能是化学变化,错误;D.化学反应达到平衡状态时,只要条件不改变,平衡就不变,所以各物质的浓度就不再改变,正确。
考点:考查物质的性质及变化的知识。

金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列结论正确的是
| A.石墨比金刚石稳定 |
| B.金刚石比石墨稳定 |
| C.1mol石墨比1mol金刚石的总能量高 |
| D.1mol石墨和1mol金刚石的总能量相等 |
下列热化学方程式,正确的是:
| A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g)ΔH= -296kJ/mol |
| B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为: N2(g)+3H2(g)  2NH3(g)△H= -73kJ/mol 2NH3(g)△H= -73kJ/mol |
| C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g)ΔH=-890.3kJ·mol-1 |
| D.强酸强碱的中和热为- 57.3 kJ/mol: |
已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ·mol-1
C(s)+O2 (g)=CO2(g), △H2= -393.5kJ/mol 则 C(s)+CO2(g)="2CO(g)" 的△H为
| A.283. kJ·mol-1 | B.+172.5 kJ·mol-1 |
| C.-172.5 kJ·mol-1 | D.-504 kJ·mol-1 |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
已知反应: ①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol 下列结论正确的是( )
| A.碳的燃烧热大于110.5kJ/mol |
| B.反应①放出的热量为221kJ |
| C.稀硫酸与稀氨水溶液反应的中和热为-57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |