题目内容
下列变化为放热的化学反应的是 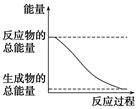
| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如右图所示的化学反应 |
D
解析试题分析:A、状态变化,不是化学反应,故A错误;B、ΔH>0,为吸热反应,故B错误;C、只知道形成化学键时放出的热量,不知道断裂化学键时吸收的能量,不能判断是吸热反应还是放热反应,故C错误;D、反应物的总能量大于生成物的总能量,故为放热反应,故D正确;故选D。
考点:放热反应的判断。

练习册系列答案
相关题目
下列热化学方程式,正确的是:
| A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g)ΔH= -296kJ/mol |
| B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为: N2(g)+3H2(g)  2NH3(g)△H= -73kJ/mol 2NH3(g)△H= -73kJ/mol |
| C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g)ΔH=-890.3kJ·mol-1 |
| D.强酸强碱的中和热为- 57.3 kJ/mol: |
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
下列反应中,属于吸热反应的是
| A.活泼金属跟酸反应 | B.制造水煤气 | C.酸碱中和反应 | D.镁条燃烧 |
生活中每时每刻都发生着各种化学反应,下列反应不一定属于放热反应的是( )
| A.硫酸和氢氧化钡溶液的反应 | B.燃烧反应 |
| C.复分解反应 | D.中和反应 |
下列设备工作时,将化学能转化为热能的是
| A | B | C | D |
 |  |  |  |
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
下列反应中,属于吸热反应的是
| A.活泼金属跟酸反应 | B.煤气燃烧 | C.酸碱中和反应 | D.工业制生石灰 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化,但不一定有能量变化 |
| B.CaO+H2O=Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量 |
| C.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |