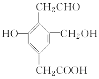
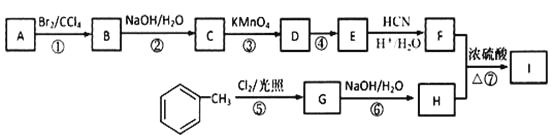
题目内容
【题目】由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为44%,则氢元素的质量分数为( )
A. 48%B. 8%C. 56%D. 10%
【答案】B
【解析】
甲酸甲酯为C2H4O2,葡萄糖为C6H12O6,乙醛为C2H4O,丙酸为C3H6O3,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量发生计算混合物中碳元素与氢元素的质量分数之和,再根据碳元素与氢元素质量关系计算。
甲酸甲酯为C2H4O2,葡萄糖为C6H12O6,乙醛为C2H4O,丙酸为C3H6O3,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氧的质量分数为44%,则混合物中碳元素与氢元素的质量分数之和为1-44%=56%,故混合物中氢元素的质量分数=56%×![]() =8%,
=8%,
所以B选项是正确的。

练习册系列答案
相关题目