题目内容
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
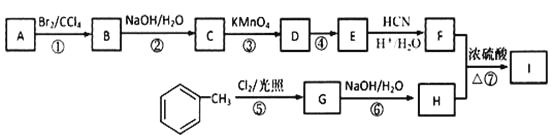
已知:①A 属于脂肪烃,核磁共振氢谱显示有 2 组峰,面积比为 3:1,其蒸气密度是相同条件下 H2 的 28 倍;D 分子式为C4H8O3;E 分子式为 C4H6O2,能使溴水褪色。
②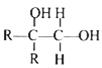
![]()
 其中 R 为烃基。
其中 R 为烃基。
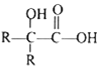
③![]()
![]()
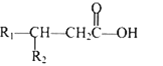 其中 R1 和 R2 均为烃基。
其中 R1 和 R2 均为烃基。
回答下列问题:
(1)A 的结构简式为_______。
(2)D 中官能团的名称是_______。
(3)反应②化学方程式为_______。
(4)E的同系物K 比E 多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是_______ (填序号)。
(6)反应⑦的化学方程式为_______。
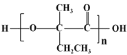
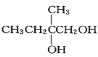
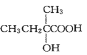
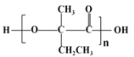
(7)参照上述合成路线,以![]() 原料(无机试剂任选),经 4 步反应制备可降解塑料
原料(无机试剂任选),经 4 步反应制备可降解塑料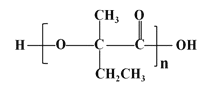 _______ (例如合成流程CH3CH2Br
_______ (例如合成流程CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3)
CH3COOCH2CH3)
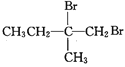
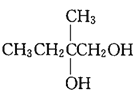
【答案】CH3C(CH3)=CH2 羟基、羧基 CH3CBr(CH3)CH2Br+2NaOH![]() CH3C(OH)(CH3)CH2OH+2NaBr 8 ②⑤⑥⑦ 2
CH3C(OH)(CH3)CH2OH+2NaBr 8 ②⑤⑥⑦ 2![]() +
+![]()
![]()
![]() +2H2O
+2H2O ![]()
![]()
![]()
![]()
![]()
【解析】
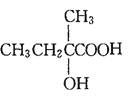
M(A)=28×2=56,由D、E的分子式,可确定A分子中含有4个碳原子,从而得出A的分子式为C4H8,由信息“A 属于脂肪烃,核磁共振氢谱显示有 2 组峰,面积比为 3:1”,可确定A的结构简式为![]() ;则与Br2/CCl4发生加成反应生成B的结构简式为
;则与Br2/CCl4发生加成反应生成B的结构简式为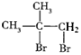 ,在NaOH/H2O作用下发生水解生成C,其结构简式为
,在NaOH/H2O作用下发生水解生成C,其结构简式为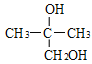 ;加入KMnO4氧化生成D的结构简式为
;加入KMnO4氧化生成D的结构简式为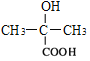 ,由E能与HCN发生加成反应,则E含有碳碳双键,E的结构简式为CH2=C(CH3)COOH,F的结构简式为HOOCCH2CH(CH3)COOH。甲苯在光照条件下与Cl2反应生成G,其结构简式为
,由E能与HCN发生加成反应,则E含有碳碳双键,E的结构简式为CH2=C(CH3)COOH,F的结构简式为HOOCCH2CH(CH3)COOH。甲苯在光照条件下与Cl2反应生成G,其结构简式为![]() ;G在NaOH/H2O作用下生成H,其结构简式为
;G在NaOH/H2O作用下生成H,其结构简式为![]() ,I的结构简式为
,I的结构简式为![]() 。
。
(1)由以上分析知,A的结构简式为![]() ;答案为:
;答案为:![]() ;
;
(2)D的结构简式为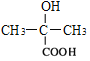 ,官能团的名称是羟基、羧基;答案为:羟基、羧基;
,官能团的名称是羟基、羧基;答案为:羟基、羧基;
(3)反应②为 在NaOH/H2O作用下发生水解生成
在NaOH/H2O作用下发生水解生成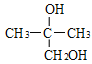 ,化学方程式为
,化学方程式为 +2NaOH
+2NaOH![]()
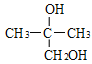 +2NaBr;答案为:
+2NaBr;答案为: +2NaOH
+2NaOH![]()
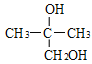 +2NaBr;
+2NaBr;
(4)E的同系物K 比E 多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解,则E的结构框架为HCOOC4H7,异构体的数目就是-C4H7的异构体的数目,有8种;答案为:8;
(5)反应①~⑦中,①为加成反应、③为氧化反应、④为消去反应,其余都属于取代反应,它们是②⑤⑥⑦;答案为:②⑤⑥⑦;
(6)反应⑦的化学方程式为2![]() +
+![]()
![]()
![]() +2H2O。答案为:2
+2H2O。答案为:2![]() +
+![]()
![]()
![]() +2H2O;
+2H2O;
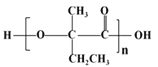
(7)  的单体为
的单体为 ,由
,由![]() 为原料,先与Br2/CCl4发生加成反应,然后水解、氧化,即可制得可降解塑料
为原料,先与Br2/CCl4发生加成反应,然后水解、氧化,即可制得可降解塑料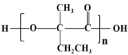 ,即合成路线为
,即合成路线为![]()
![]()
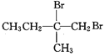
![]()
![]()
![]()
 ;答案为:
;答案为:![]()
![]()

![]()

![]()

![]()
 。
。

 名校课堂系列答案
名校课堂系列答案【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。