题目内容
【题目】小明按右图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象。
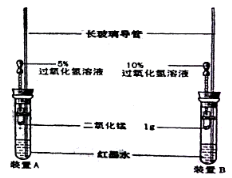
(1)小明的实验目的是:__________________________。
(2)装置中长玻璃导管的作用是:____________________;红墨水的作用是_________________。
(3)你估计两根玻璃导管中的实验现象是____________________;理由是___________________。
【答案】(1)比较相同催化剂的作用下,不同浓度、同体积过氧化氢溶液分解反应速率的大小或研宄浓度对化学反应速度的影响。(意思相同均给分)(2)相同的液体体积变化在细长的玻璃导管中造成的液面高度变化大,便于观察(意思相同均给分);写成平衡内外气压也给分,使导管中的液柱呈现红色,便于观察导管中液面高度的变化。(3)两装置中导管内的液面均上升,装置B中导管内液面的上升速度比装置A的快:等体积的浓度大的过氧化氢溶液在相同催化剂的情况下分解速率快,单位时间内产生的气体多,压上的液柱高度增高。(意思相同均给分)
【解析】
试题分析:(1)根据图示可知:采用对照实验,使H2O2浓度不同,其它条件相同可见其目的是探究浓度对化学反应速率的影响;
(2)装置中长玻璃导管的作用是使相同体积的液体的长度增大,便于观察实验现象,使得到的结论与理论相吻合;红墨水的作用是使液体物质变为红色,便于观察导管中液面高度的变化;
(3)过氧化氢溶液在相同催化剂的情况下分解产生O2,将试管中的液体压入细长玻璃导管中,由于装置B中H2O2的浓度大,反应速率快,相同时间产生的氧气多,实验进入玻璃管中都是液体多,因此会观察到两装置中导管内的液面均上升,装置B中导管内液面的上升速度比装置A的快,浓度大的上升的快而且导管增加的高度大。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是

下列说法正确的是
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+ H2O =HClO+CO32-
C.图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
