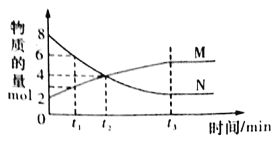
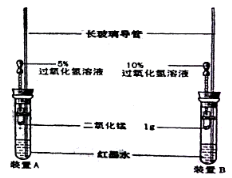
题目内容
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A.0.1(b﹣2a) molL﹣1
B.10(2a﹣b) molL﹣1
C.10(b﹣a) molL﹣1
D.10(b﹣2a) molL﹣1
【答案】D
【解析】
试题分析:混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42﹣=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl﹣=AgCl↓,恰好使氯离子完全沉淀,则n(Cl﹣)=n(Ag+),
再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl﹣),据此计算每份中n(K+),根据c=![]() 计算钾离子浓度.
计算钾离子浓度.
解:混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42﹣=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=amol;
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl﹣=AgCl↓,恰好使氯离子完全沉淀,则n(Cl﹣)=n(Ag+)=bmol,
根据电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl﹣),每份溶液中n(K+)=bmol﹣2amol=(b﹣2a)mol,故钾离子浓度为![]() =10(b﹣2a) molL﹣1,
=10(b﹣2a) molL﹣1,
故选D.

【题目】W、X、Y、Z四种短周期元素的原子序数:X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子数与p电子数之比为1:1,Y原子最外层s电子数之比为1:1,Z原子的p电子数比Y原子的多2个.
(1)四种元素原子半径从大到小的顺序为 (用元素符号表示).
(2)请用“>”或“<”填空:
第一电离能 | 电负性 | 氢化物沸点 | 最高价氧化物对应水化物的碱性 |
W X | Z Y | Y Z | W X |
(3)写出X元素的单质与Z、Y所形成的化合物反应的化学方程式,并标出电子转移的方向和数目: .
【题目】(1)用O2将HC1转化为Cl2,可提高效益,减少污染,传统上该转化通过如下图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s) ![]() H2O(g)+CuCl2(s) △H1,反应②生成1 mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为____________________________。(反应热用△H1和△H2表示)。
H2O(g)+CuCl2(s) △H1,反应②生成1 mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为____________________________。(反应热用△H1和△H2表示)。
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量浓度变化表示的反应速率 _________。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

0~tl时,原电池的负极是Al片,此时,正极的电极反应式是______________,溶液中的H+向______极移动,tl时,原电池中电子流动方向发生改变,其原因是_____________。
【题目】化合物A、B是中学常见的物质,其阴、阳离子只能从表中选择:
阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
阴离子 | OH﹣、NO3﹣、I﹣、HCO3﹣、AlO2﹣、HSO4﹣ |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性.混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体.
①B的化学式为 .
②A、B溶液混合加热反应的离子方程式 .
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为 .
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ ;Ⅱ .
③请用一简易方法证明上述溶液变黄的原因 .