��Ŀ����
����Ŀ����֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.4��10��7 Ka2=4.7��10��11 |
��ͼ��ʾ�����£�ϡ��CH3COOH��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����

����˵����ȷ����
A����ͬŨ�ȵ�CH3COONa��NaClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)> c(ClO��)> c(CH3COO��)> c(OH��)> c(H+��
B����NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��ClO��+CO2+ H2O =HClO+CO32��
C��ͼ����a��c���㴦����Һ��![]() �����HR����CH3COOH��HClO��
�����HR����CH3COOH��HClO��
D��ͼ����a�������Ũ�ȴ���b�������Ũ��
���𰸡�C
��������
������������ݱ��е��볣����֪��������ǿ������˳��ΪCH3COOH> H2CO3>HClO>HCO3����������ӵ������ɴ�С��˳��ΪCO32��>ClO��> HCO3��>CH3COO����A��ClO����ˮ��̶ȴ���CH3COO����ˮ��̶ȣ�ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵӦ��c(Na����>c(CH3COO����>c(ClO����>c(OH����>c(H������A����B��CO32��������ӵ���������ClO��������ӵ����������ӷ���ʽӦΪClO����CO2�� H2O=HClO��HCO3����B����C��![]() ����Ϊ
����Ϊ![]() ���¶���ͬ�����ʽ��ֵ��ȣ�C��ȷ��D��CH3COOH������ǿ��HClO��pHֵ��ͬʱ��HClO��Ũ�ȴ���CH3COOH��Ũ�ȣ�D��������ѡC��
���¶���ͬ�����ʽ��ֵ��ȣ�C��ȷ��D��CH3COOH������ǿ��HClO��pHֵ��ͬʱ��HClO��Ũ�ȴ���CH3COOH��Ũ�ȣ�D��������ѡC��

����Ŀ����1����O2��HC1ת��ΪCl2�������Ч�棬������Ⱦ����ͳ�ϸ�ת��ͨ������ͼ��ʾ�Ĵ���ѭ��ʵ�֣�
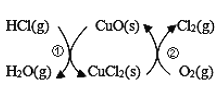
���У���Ӧ��Ϊ��2HCl(g)+CuO(s) ![]() H2O(g)+CuCl2��s�� ��H1����Ӧ������1 mol Cl2 (g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________������Ӧ������H1����H2��ʾ����
H2O(g)+CuCl2��s�� ��H1����Ӧ������1 mol Cl2 (g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________������Ӧ������H1����H2��ʾ����
��2��һ�������²��������Ӧ������c(Cl2)���������£�
t��min�� | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0min����HCl�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���� _________��
��3�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ���������
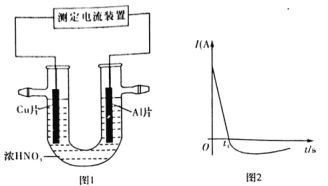
0��tlʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ��______________����Һ�е�H+��______���ƶ���tlʱ��ԭ����е��������������ı䣬��ԭ����_____________��
����Ŀ����֪�����������Һ��ϡH2SO4��Ӧ�����������������Na2S2O3��H2SO4===Na2SO4��S����SO2����H2O��ijͬѧ���±�����ʵ�飬�����ж���һ���ȳ��ֻ��ǡ�
��� | ��3%Na2S2O3/mL | ��1��5��H2SO4/�� | �¶�/�� |
1 | 5 | 25 | 25 |
2 | 5 | 15 | 35 |
3 | 5 | 25 | 45 |