题目内容
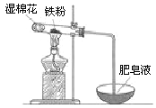
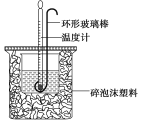
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
(1)碎泡沫塑料的作用是____________________环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么
(2)该实验测得的中和热数值为 kJ·mol-1, (盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值 (“偏大”、“偏小”或“不变”)
【答案】(1)保温隔热,减少热量损失;不可以;铜的导热性好,易损失热量产生误差
(2)56.8
(3)偏小
【解析】
试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:保温、隔热,减少实验过程中的热量损失;不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,易损失热量产生误差。
故答案为:保温隔热,减少热量损失;不可以;铜的导热性好,易损失热量产生误差;
(2)第1次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.7℃,反应前后温度差为:3.4℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应前后温度差为:3.4℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:4.35℃;
50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量
Q=4.18J/(g℃)×100g×![]() =1.414kJ,即生成0.025mol的水放出热量为:1.414kJ,所以生成1mol的水放出热量为:1.414kJ÷0.02=56.8kJ。即该实验测得的中和热△H=-56.8kJ/mol,
=1.414kJ,即生成0.025mol的水放出热量为:1.414kJ,所以生成1mol的水放出热量为:1.414kJ÷0.02=56.8kJ。即该实验测得的中和热△H=-56.8kJ/mol,
故答案为:-56.8;
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,由于氨水属于弱电解质,电离过程中会吸收部分热量,所以测得中和热的数值偏小。
故答案为:偏小。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案