题目内容
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
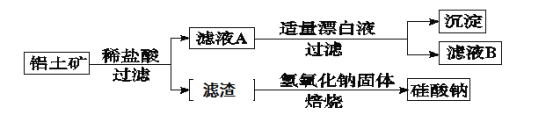
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
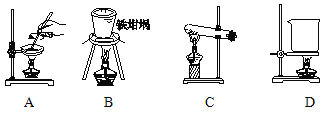
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
【答案】(1)2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+
(2)加入铁氰化钾溶液产生蓝色沉淀或滴加高锰酸钾溶液,紫红色褪去
(3)c (4)过滤 (5)SiO2 B SiO2+2NaOH=Na2SiO3+H2O(焙烧)
【解析】
试题分析:(1)根据方程式可知,铁元素的化合价从+2价升高到+3价,失去1个电子。氯元素的化合价从+1价降低到-1价,得到2个电子,则根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是2:1。根据原子守恒与电荷守恒可知,反应前有水参加,反应后有氢离子生成,因此配平后的方程式是2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+。
(2)亚铁离子具有还原性,因此检验亚铁离子的实验操作可以是取少量滤液B,加入高锰酸钾溶液,紫红色褪去,说明含有亚铁离子。
(3)滤液B中的铝元素以Al3+的形式存在,要以沉淀形式析出,需要加入碱液。由于氢氧化铝是两性氢氧化物,所以不能选择强碱,最好选择弱碱氨水,答案选c。
(4)冷却结晶后有晶体析出,因此分离出晶体的实验操作应该是过滤。
(5)二氧化硅与盐酸不反应,因此滤渣的主要成分是二氧化硅。A、该实验操作是蒸发,不能熔融二氧化硅和氢氧化钠,A错误;B、装置是铁坩埚,可以熔融二氧化硅和氢氧化钠,B正确;C、装置是试管,不能熔融二氧化硅和氢氧化钠,C错误;D、装置是烧杯,烧杯不能熔融氢氧化钠,D错误,答案选b。

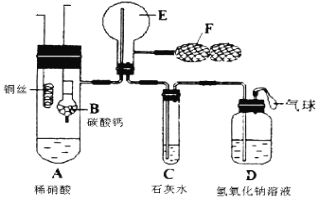
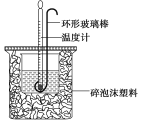
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
(1)碎泡沫塑料的作用是____________________环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么
(2)该实验测得的中和热数值为 kJ·mol-1, (盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值 (“偏大”、“偏小”或“不变”)