��Ŀ����
����Ŀ�����������ճ���������;�㷺�Ľ�����
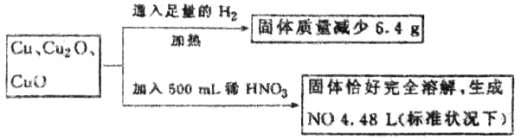
��1�������£�����������������ʢװŨ�����ԭ����____ ��
��2������������������װNaOH�ȼ���Һ��ԭ����(�����ӷ���ʽ��ʾ) ��
��3����ҵ��ұ��������Ӧ�Ļ�ѧ����ʽΪ_
��4��ijʵ��С��������ͼװ����֤����ˮ�����ķ�Ӧ��
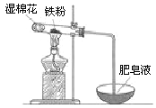
��ʪ���������� ���Թ��з�Ӧ�Ļ�ѧ����ʽ�� _��
��ʵ�������ȡ��������Ӧ��Ĺ������Թ��У�����������ᣬ������ȫ�ܽ⣬������Һ�д��ڵ���������___________(�����)��
a��һ����Fe2+��H+��Fe3+ b��һ����Fe2+��H+��������Fe3+
c��һ����Fe2+��Fe3+�������� H+ d��һ����Fe3+��H+��������Fe2+
���𰸡���1��Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)
��2��2Al+2OH��+ 2H2O =2AlO2�� + 3H2��
��3��2Al2O3![]() 4Al+ 3O2��
4Al+ 3O2��
��4�����ṩˮ���� 3Fe+ 4H2O(g)![]() Fe3O4 + 4H2���� b
Fe3O4 + 4H2���� b
��������
�����������1�������£�Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ����������������ʢװŨ���ᣬ�ʴ�Ϊ��Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ��
��2��������NaOH��Һ��Ӧ��2Al+2OH��+ 2H2O =2AlO2�� + 3H2����������������װNaOH�ȼ���Һ���ʴ�Ϊ��2Al+2OH��+ 2H2O =2AlO2�� + 3H2����
��3����ҵ���õ�����ڵ�������ұ��������Ӧ�Ļ�ѧ����ʽΪ2Al2O3![]() 4Al+ 3O2�����ʴ�Ϊ��2Al2O3
4Al+ 3O2�����ʴ�Ϊ��2Al2O3![]() 4Al+ 3O2����
4Al+ 3O2����
��4������Ϊ������ˮ�����ķ�Ӧ���Թ��������ۣ�����ʪ����Ҫ���ṩˮ���������ڸ�������ˮ��Ӧ������������������������Ӧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O
Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
������ˮ������Ӧ������Ϊ����������������������������ᣬ������ȫ�ܽ⣬�ط�����Ӧ��Fe3O4+8HCl=FeCl2+2FeCl3+4H2O������������Һ�д��ڵ���������һ����Fe2+��H+��������������ɫ�����п��ܺ��й������������ܽ�����������ȫ��ת���ɶ��������ӣ�Fe+2Fe3+�T3Fe2+������������Һ�д��ڵ���������һ����Fe2+��H+��������Fe3+���ʴ�Ϊ��b��

 ��Ӣ���㿨ϵ�д�
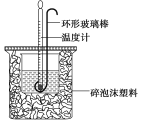
��Ӣ���㿨ϵ�д�����Ŀ��ʵ������50 mL 0.50 mol��L��1���ᡢ50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾװ�ý��вⶨ�к��ȵ�ʵ�飬�õ����е�����
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | NaOH��Һ | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
��1������ĭ���ϵ�������____________________���β���������ɲ�������ͭ˿��������棬Ϊʲô
��2����ʵ���õ��к�����ֵΪ kJ��mol��1, (�����NaOH��Һ���ܶȰ�1 g��cm��3���㣬��Ӧ������Һ�ı�����(c)��4.18 J��(g����)��1����)��
��3������NaOH��Һ��Ϊ��ͬ�������ͬŨ�ȵİ�ˮ������к��ȵ���ֵ ����ƫ����ƫС�����䡱��