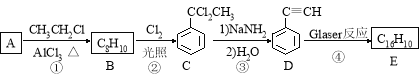
题目内容
【题目】随着卤素的原子半径的增大,下列递变规律正确的是( )
A. 单质的熔点逐渐降低 B. 卤素离子还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质氧化性逐渐增强
【答案】B
【解析】A.卤素单质都是分子晶体,其熔沸点与相对分子质量成正比,随着原子序数增大,其相对分子质量增大,单质的熔沸点逐渐升高,故A错误;B.卤族元素从上到下,元素的非金属性逐渐减弱,卤素离子的还原性逐渐增强,故B正确;C.元素的非金属性越强,其氢化物的稳定性越强,卤素随着原子序数增大其非金属性减弱,则气态氢化物稳定性逐渐减弱,故C错误;D.随着原子序数增大,元素的非金属性逐渐减弱,则其单质的影响逐渐减弱,故D错误;答案为B。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3= + 44.0kJ·mol-1
H2O(g)ΔH3= + 44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的逆反应平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.增大CO2和H2的初始投料比 E.投料比不变,增加反应物的浓度
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
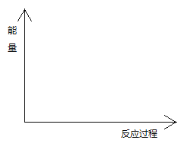
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。
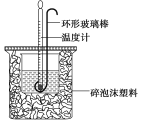
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
(1)碎泡沫塑料的作用是____________________环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么
(2)该实验测得的中和热数值为 kJ·mol-1, (盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值 (“偏大”、“偏小”或“不变”)