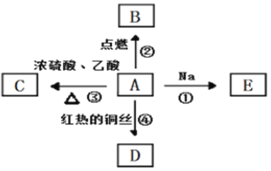
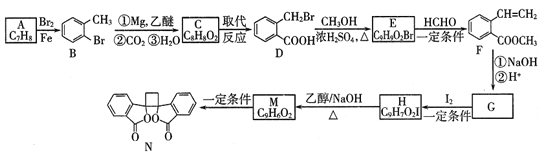
题目内容
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有二氧化硅、氧化铝等杂质。制备流程如图所示:
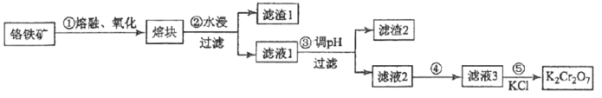
(1)步骤①的主要反应为:FeOCr2O3+NaOH+O2![]() Na2CrO4+Fe2O3+H2O 。
Na2CrO4+Fe2O3+H2O 。
上述反应配平后氧化剂与还原剂的系数比为__________。
若在实验室中进行步骤①,应该在_______中进行(填序号)
A.石英坩埚 B.铁制坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)滤渣1中含量最多的金属元素是__________(填元素符号);滤渣2的主要成分是_________及含硅杂质;步骤③调滤液1的pH使之变_________(填“大”或“小”)
(3)向“滤液3”中加入适量KCl,经结晶过滤得到K2Cr2O7固体。步骤⑤的反应类型是___________反应。
(4)某工厂用380 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品250 kg,产率为________×100%(保留2位有效数字,M(Cr2O3)=152g/mol;M(K2Cr2O7)=294g/mol)
【答案】7:4 B Fe Al(OH)3 小 复分解 85
【解析】
铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为4FeOCr2O3+16NaOH+7O2![]() 8Na2CrO4+2Fe2O3+8H2O,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,O元素的化合价由0价降低为-2价,由电子、原子守恒可知,反应为4FeOCr2O3+16NaOH+7O2
8Na2CrO4+2Fe2O3+8H2O,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,O元素的化合价由0价降低为-2价,由电子、原子守恒可知,反应为4FeOCr2O3+16NaOH+7O2![]() 8Na2CrO4+2Fe2O3+8H2O,该步骤不能使用石英坩埚、氧化铝坩埚、陶瓷容器,原因是二氧化硅与氢氧化钠高温下反应生成硅酸钠和水,氧化铝与氢氧化钠高温下反应生成偏铝酸钠和水,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、含Si物质,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+
8Na2CrO4+2Fe2O3+8H2O,该步骤不能使用石英坩埚、氧化铝坩埚、陶瓷容器,原因是二氧化硅与氢氧化钠高温下反应生成硅酸钠和水,氧化铝与氢氧化钠高温下反应生成偏铝酸钠和水,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、含Si物质,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+![]() Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出。
Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出。
(1)步骤①的主要反应为:4FeOCr2O3+16NaOH+7O2![]() 8Na2CrO4+2Fe2O3+8H2O 。
8Na2CrO4+2Fe2O3+8H2O 。
上述反应配平后氧化剂与还原剂的系数比为7:4。
若在实验室中进行步骤①,该步骤不能使用石英坩埚、氧化铝坩埚、陶瓷容器,原因是二氧化硅与氢氧化钠高温下反应生成硅酸钠和水,氧化铝与氢氧化钠高温下反应生成偏铝酸钠和水,故选B。
故答案为:7:4 ;B ;
(2)熔块水浸过滤分离出滤渣1含Fe2O3,滤渣1中含量最多的金属元素是Fe(填元素符号);滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、含Si物质,故滤渣2的主要成分是Al(OH)3及含硅杂质;步骤③调滤液1的pH使之变小,增大氢离子浓度;
故答案为: Fe ;Al(OH)3 ;小;
(3)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度可知,冷却到40℃K2Cr2O7固体的溶解度在四种物质中较小,发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的原因是:K2Cr2O7的溶解度小,反应类型为复分解;
故答案为:复分解;
(4)用380 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 250 kg,产率为![]() ×100%,由Cr原子守恒可知,由Cr原子守恒可知,则产率=
×100%,由Cr原子守恒可知,由Cr原子守恒可知,则产率= =×100%=85%;
=×100%=85%;
故答案为:85。

【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |