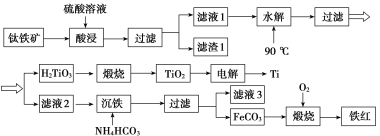
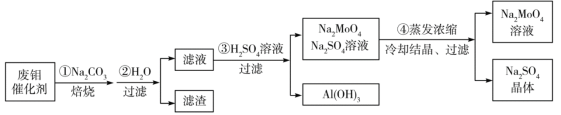
��Ŀ����
����Ŀ����һ��Һ����ȷ���Ƿ����������ӣ�K����Mg2����Fe3����Ba2����SO42-��Cl����I����HCO3-��ʵ�����£�
ʵ�鲽�� | ʵ������ |
���ò�����պȡ��������Һ������pH��ֽ�в� | ��ֽ��Ϊ��ɫ |
��ȡ��������Һ������BaCl2��Һ | �а�ɫ�������� |
��ȡ���з�Ӧ����ϲ���Һ������AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
��ȡ��������Һ������NaOH��Һ | ֻ�к��ɫ�������� |
�����ж���ȷ���ǣ�������
A.��Һ��������ֻ��Fe3��
B.����û��Na������ɫ��Ӧ�۲�K��ʱ��������ɫ���ܲ���
C.����û�в���٣�Ҳ��Ӱ����Һ�����ӵ��ж�
D.����ܷ�����Ӧ�����ӷ���ʽֻ�У�Fe3����3OH��=Fe��OH��3��
���𰸡�C
��������
�ٲ�pH��ֽ��죬˵����Һ�����ԣ�HCO![]() ���ܴ������ڣ��ڲ�˵����SO
���ܴ������ڣ��ڲ�˵����SO![]() ��Ba2���Ͳ��ܴ������ڣ��۲�����˵����Cl������Ϊ����������Cl�����ܲ�˵����Fe3����
��Ba2���Ͳ��ܴ������ڣ��۲�����˵����Cl������Ϊ����������Cl�����ܲ�˵����Fe3����
A.��Һ��һ������Fe3����H�������ܺ���K+��A����
B.�����Ƿ���Na����ֻҪ�ǹ۲�ص���ɫ������������ɫ�ܲ�����B����
C.û�в���٣��ܲ�˵����Fe3����Ҳ��������Һ�����ԣ���Ӱ����Һ�����ӵ��жϣ�C��ȷ��
D.����ܷ����ķ�Ӧһ���У�Fe3����3OH��=Fe(OH)3����H����OH��=H2O��D����
��ѡC��

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д� Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�����Ŀ���±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ���Ӧԭ�Ӱ뾶�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||||
A | B | C | D | E | F | G | H | |
ԭ�Ӱ뾶(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
����ϼ� | +6 | +5 | +4 | +5 | +7 | +1 | ||
��ͻ��ϼ� | ��2 | ��3 | ��4 | ��2 | ��3 | ��1 | ��1 | 0 |
��֪����A��D���γɻ�����AD2��AD3����E��D���γɶ��ֻ��������ED��ED2�dz����Ļ����C�������ƹ��ء�
(1)�õ���ʽ��ʾA���⻯��������H ������������Ӧˮ���ﷴӦ���ɵ��ε��γɹ��̣�____________________________________________________________��
(2)E�ļ���̬�⻯�K������ˮ��ԭ���У���_____________________________��
��____________________________________________��
(3)�������ΪADG2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᡣ�÷�Ӧ�Ļ�ѧ����ʽ��_______________��
(4)����״����40L��ɫ����ED��15L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Ρ���д���÷�Ӧ�����ӷ���ʽ_______________________��