题目内容
17.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.
(1)写出A、D按原子个数比1:1形成的化合物的电子式:
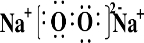 .
.(2)E、F两种元素的最简单气态氢化物中稳定性较强的是HCl(填化学式).
(3)A、E、F三种简单离子半径由大到小的顺序为S2->Cl->Na+(填离子符号).
(4)C的红棕色氧化物与D的氢化物反应的化学方程式为3NO2+H2O=2HNO3+NO,该反应中氧化剂与还原剂的物质的量之比为1:2.
分析 由元素在周期表中的位置可知,A是Na,B是C,C是N,D是O,E是S,F是Cl,
(1)A、D按原子个数比1:1形成的化合物为Na2O2,为离子化合物;
(2)同周期元素的原子,从左到右非金属性逐渐增强,氢化物的稳定性逐渐增强;
(3)离子的电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
(4)C的红棕色氧化物与D的氢化物反应生成硝酸和NO;二氧化氮为氧化剂也是还原剂.
解答 解:由元素在周期表中的位置可知,A是Na,B是C,C是N,D是O,E是S,F是Cl,
(1)A、D按原子个数比1:1形成的化合物为Na2O2,为离子化合物,其电子式为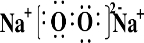 ,故答案为:
,故答案为: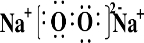 ;
;
(2)非金属性Cl>S,则氢化物的稳定性较强的为HCl,故答案为:HCl;
(3)离子的电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,A、E、F三种简单离子半径由大到小的顺序为S2->Cl->Na+,
故答案为:S2->Cl->Na+;
(4)C的红棕色氧化物与D的氢化物反应生成硝酸和NO,反应为3NO2+H2O=2HNO3+NO,二氧化氮为氧化剂也是还原剂,则氧化剂与还原剂的物质的量之比为1:2,
故答案为:3NO2+H2O=2HNO3+NO;1:2.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析、推断及应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
7.下列有关图象说法正确的是( )
| A. | 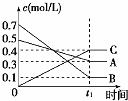 表示反应的方程式为5A(g)+7B(g)?4C(g) | |
| B. | 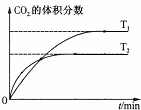 表示反应5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 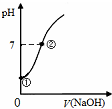 表示向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 | |
| D. | 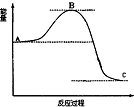 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
8.下列关于化学键的说法正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
5.下列反应产物中,一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 丁烷与氯气光照条件下生成的一氯代物 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 2-丁烯与水的加成反应 |
12.某元素原子M层电子数是K层电子数的3.5倍,则该元素最高价氧化物对应水化物的化学式为( )
| A. | HClO4 | B. | HNO3 | C. | H2SO4 | D. | H3PO4 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA | |
| B. | 1mol CH${\;}_{5}^{+}$中含有的电子数目为11NA | |
| C. | 28g聚乙烯中含有的碳原子数目为2NA | |
| D. | 0.1mol•L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA |
9.向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+3OH-?Cr(OH)3(灰蓝色)?CrO2-(绿色)+H++H2O.将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液.a、b试管中溶液颜色最终分别为( )
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |
6.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |
7.下列各组中能互称为同位素的是( )
| A. | D和T | B. | H2和D2 | C. | 金刚石和石墨 | D. | N≡N和N2 |