题目内容
11.用KMnO4氧化溶质质量分数为36.5%的盐酸的HCl.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O(1)15.8g KMnO4能与多少克该盐酸恰好发生上述反应?有多少克HCl被氧化?
(2)反应产生的Cl2在标准状况下的体积为多少?
分析 (1)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,结合反应可知,消耗HCl为0.1mol×$\frac{16}{2}$=0.8mol,其中$\frac{10}{16}$被氧化;
(2)由反应可知,0.1molKMnO4反应生成氯气为0.1mol×$\frac{5}{2}$,结合V=nVm计算.
解答 解:(1)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,结合2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O可知,消耗HCl为0.1mol×$\frac{16}{2}$=0.8mol,消耗盐酸为$\frac{0.8mol×36.5g/mol}{36.5%}$=80g,其中$\frac{10}{16}$被氧化,则被氧化的HCl的质量为0.8mol×$\frac{10}{16}$×36.5g/mol=18.25g,
答:15.8g KMnO4能与80克该盐酸恰好发生上述反应,有18.25克HCl被氧化;
(2)由反应可知,0.1molKMnO4反应生成氯气为0.1mol×$\frac{5}{2}$=0.25mol,反应产生的Cl2在标准状况下的体积为0.25mol×22.4L/mol=5.6L,
答:反应产生的Cl2在标准状况下的体积为5.6L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及反应中物质的量关系、以物质的量为中心的计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.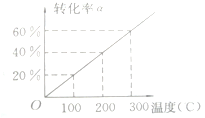 已知反应:X(g)+2Y(g)?2Z(g),将X和Y气体按体积比1:2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态,此时反应物、生成物的物质的量之比为6:1,则如右图所示,此时反应对应的温度为( )
已知反应:X(g)+2Y(g)?2Z(g),将X和Y气体按体积比1:2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态,此时反应物、生成物的物质的量之比为6:1,则如右图所示,此时反应对应的温度为( )
 已知反应:X(g)+2Y(g)?2Z(g),将X和Y气体按体积比1:2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态,此时反应物、生成物的物质的量之比为6:1,则如右图所示,此时反应对应的温度为( )
已知反应:X(g)+2Y(g)?2Z(g),将X和Y气体按体积比1:2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态,此时反应物、生成物的物质的量之比为6:1,则如右图所示,此时反应对应的温度为( )| A. | 100℃ | B. | 200℃ | C. | 300℃ | D. | 400℃ |
6.下列物质既能与金属钠反应放出气体,又能与纯碱作用放出气体的是( )
| A. | CH3CH2OH | B. | H2O | C. | CH3COOH | D. | C6H12O6 |
3.下列各原子或离子的电子排布式错误的为( )
| A. | Na+ 1s22s22p6 | B. | F- 1s22s22p6 | ||
| C. | N3- 1s22s22p3 | D. | O 1s22s22p4 |
1.下面有关晶体的叙述中,正确的是( )
| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | .离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键 | |
| C. | .分子晶体中分子间作用力越大,分子越稳定 | |
| D. | .原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |