题目内容
12.实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放上蒸发皿;②放置酒精灯;③固定铁圈位置;④加热搅拌;⑤停止加热、余热蒸干.其正确操作的顺序是( )| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
分析 溶液蒸发需要酒精灯,先放置酒精灯,依据酒精灯外焰位置固定铁架台铁圈位置,再放蒸发皿等,据此解答即可.
解答 解:实验时,安装仪器应先下后上,先左后右,正确顺序为:放置酒精灯;固定铁圈位置;放上蒸发皿;加热搅拌;停止加热.即②①③④⑤,故选C.
点评 本题主要考查了物质的提纯的原理-蒸发的操作,题目难度不大,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
6.A、B、C、D为原子序数依次增大的短周期元素,它们原子的最外层电子数之和为14,B与D同主族,C+与B2-具有相同的电子层结构,A和B能形成一种既有极性共价键又有非极性共价键的化合物,则下列叙述正确的是( )
| A. | 若A和C形成一种化合物CA,则CA属于离子化合物 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | 由于化合物A2B形成氢键,所以热稳定性:A2B>A2D | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
4.将5.6g铁粉投入盛有100mL 2mol•L-1稀硫酸的烧杯中,2min时铁粉刚好溶解完全,如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A. | v(Fe)=0.5mol•(L•min)-1 | B. | v(H2SO4)=1mol•(L•min)-1 | ||
| C. | v(H2)=0.5mol•(L•min)-1 | D. | v=(FeSO4)=0.5mol•(L•min)-1 |
7.实验室用NaOH固体配制480mL0.2mol•L-1的NaOH溶液.清回答下列问题:
(l)配制480mL0.2mol•L-1的NaOH溶液
(2)容量瓶|4.需标有以下五项中的①③⑤,
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
(l)配制480mL0.2mol•L-1的NaOH溶液
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,眼睛注视液面,直到液面接近刻度1~2cm处
(4)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有ABC(填序号).
A.在烧杯中稀释溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.容量瓶刚用蒸馏水洗净,没有烘干.
17.当用酸滴定碱时,下列操作中使测定结果(碱的浓度)偏高的是( )
| A. | 酸式滴定管滴至终点对,俯视读数 | |
| B. | 锥形瓶用蒸馏水洗后,未干燥 | |
| C. | 酸式滴定管用蒸馏水洗后,未用标准液润洗 | |
| D. | 酸式滴定管滴定至终点后,发现尖嘴处有气泡(原来无气泡) |
4. 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
下列说法正确的是②③(填序号)
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
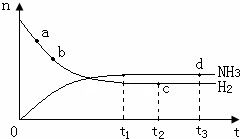
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
容器I中的反应是(选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K=1.0.表格内的空格处v(正)与v(逆)的大小关系是v(正)<v(逆).
 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
①N2 (g)+3H2 (g)?2NH3 (g)△H1
②4NH3(g)+5O2 (g)═4NO(g)+6H2O(l)△H2
③N2 (g)+O2 (g)═2NO (g)△H
能否应用△H1和△H2表示△H?若能用△H1和△H2表示△H,则写出△H=无;若不能,说明理由:不能,缺少氢气的燃烧热.
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0.氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如图:
正反应速率最大的点是a(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是cd(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线.
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳.实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
1.下列分子具有正四面体结构的是( )
| A. | CH4 | B. | CH3Cl | C. | C2H6 | D. | C2H4 |
2.下列有关合金的说法中正确的是( )
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |