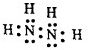
题目内容
17.当用酸滴定碱时,下列操作中使测定结果(碱的浓度)偏高的是( )| A. | 酸式滴定管滴至终点对,俯视读数 | |
| B. | 锥形瓶用蒸馏水洗后,未干燥 | |
| C. | 酸式滴定管用蒸馏水洗后,未用标准液润洗 | |
| D. | 酸式滴定管滴定至终点后,发现尖嘴处有气泡(原来无气泡) |
分析 根据实验操作对c(待测)=$\frac{n}{V}$产生的影响进行分析误差.
解答 解:A.俯视读数,溶液体积偏小,测定值偏小,故A错误;
B.锥形瓶内有少量蒸馏水对待测液的物质的量没有影响,所以不影响测定结果,故B错误;
C.未用标准液润洗,浓度变小,消耗酸的体积偏大,测定值偏高,故C正确;
D.尖嘴无气泡时开始滴定,滴定后有气泡,会导致测定标准液体积偏小,测定值偏小,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及中和滴定的误差分析、常见仪器的读数等知识,注重考查了基础知识和基本操作,本题难度中等.

练习册系列答案
相关题目
12.标准状况下,由甲烷和乙烯组成的混合气体,其密度为1g•L-1,则该混合气体中甲烷与乙烯的质量比为( )
| A. | 1:2 | B. | 2:1 | C. | 7:8 | D. | 8:7 |
5.已知可逆反应aA+bB?cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
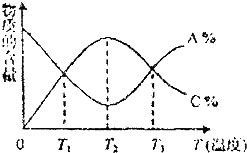

| A. | 该反应在T1、T3温度时达到过化学平衡 | |
| B. | 该反应的正反应是吸热反应 | |
| C. | 该反应在T2温度时达到过化学平衡 | |
| D. | 升高温度,平衡会向正反应方向移动 |
12.实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放上蒸发皿;②放置酒精灯;③固定铁圈位置;④加热搅拌;⑤停止加热、余热蒸干.其正确操作的顺序是( )
| A. | ②①③④⑤ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③②①④⑤ |
2.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2++SO42-+x H2O?CuSO4•xH2O,当向硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该硫酸铜晶体体积增大 | D. | 溶液的蓝色变浅 |