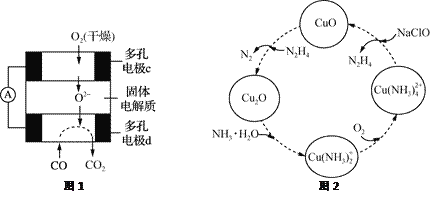
题目内容
【题目】在某固定体积的绝热密闭容器中进行的可逆反应A (g)+B(g)![]() C(s)+2D(g),可以说明己达到平衡状态的是( )
C(s)+2D(g),可以说明己达到平衡状态的是( )
①反应容器中压强不随时间变化而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④混合气体的密度不随时间变化而变化⑤化学平衡常数不变
A. ①④⑤ B. ③④ C. ①③④⑤ D. ②③
【答案】C
【解析】①反应前后体积,但温度是变化的,因此反应容器中压强始终不随时间变化而变化可以说明反应达到平衡状态,①选;②A气体和B气体的生成速率始终相等,②不选;③混合气体的平均摩尔质量不随时间变化而变化,说明气体质量不变,③选;④反应混合气体的密度不随时间变化而变化,说明气体质量不变,④选;⑤化学平衡常数不变说明温度不变,反应达到平衡状态,⑤选,答案选C。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+,下列能实现该反应的原电池是
A | B | C | D | |
电极材料 | Cu、C | Cu、Ag | Cu、Zn | Fe、Zn |
电解质溶液 | Fe(NO3)3 | FeSO4 | FeCl3 | CuSO4 |
A. A B. B C. C D. D
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大