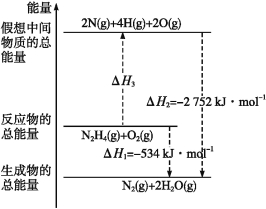
题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
【答案】AD
【解析】A.(NH4)2Fe(SO4)2中亚铁离子及铵根离子都水解,但水解程度较小,根据物料守恒得c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;B.pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合,氨水有剩余,溶液呈碱性,溶液中存在电荷守恒,根据电荷守恒得c(Cl-)<c(NH4+),故B错误;C.在0.1 mol·L-1 Na2CO3溶液中存在物料守恒,c(Na+)=2[c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)],故C错误;D.二者混合后,溶液中的溶质是等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,氯离子不水解、醋酸电离程度较小,所以离子浓度大小顺序是c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D正确;故选AD。
)+c(H2CO3)],故C错误;D.二者混合后,溶液中的溶质是等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,氯离子不水解、醋酸电离程度较小,所以离子浓度大小顺序是c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D正确;故选AD。

 学练快车道口算心算速算天天练系列答案
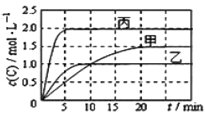
学练快车道口算心算速算天天练系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33
【题目】无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是________。

(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学 式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O |
(3)写出⑦转化为⑤的化学方程式______________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是________________。