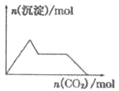
题目内容
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

经查阅资料:①HBr(氢溴酸)为一元强酸;
②Al3+、Fe3+在pH=8时完全转化为沉淀。
③V为IV过滤后的溶液。
(1)写出I溶解的离子方程式:_________________________________________。
(2)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸(密度为1.49g/cm)配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、胶头滴管、___________。
(3)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是_____________(填化学式)。
A.NaOH B. Ba(OH)2 C. NH3·H2O D. Ca(OH)2
(4)步骤Ⅴ所含的操作依次是__________________、__________________、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④烘干,冷却。⑤称量.若得到1.88g碳酸钙,则溴化钙的质量分数为_________________ (保留两位小数),若实验操作规范而测定结果偏低,其原因是_____________________。
【答案】 CaCO3+2H+ =Ca2+ +CO2↑+H2O 量筒 烧杯 D 蒸发浓缩 冷却结晶 94% 溴化钙吸水
【解析】(1)氢溴酸为强酸,写出与碳酸钙反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液,故答案为:量筒;烧杯;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙,故选D;
(4)步骤Ⅴ的结果从溶液中得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤,故答案为:蒸发浓缩,冷却结晶;
(5)CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=![]() ×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:94%;溴化钙吸水。
×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:94%;溴化钙吸水。

【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
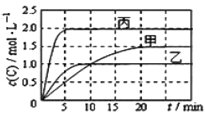
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33