题目内容
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
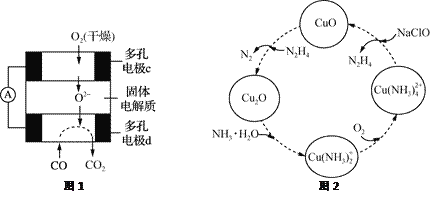
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
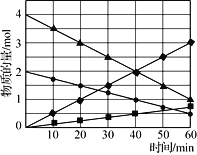
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
【答案】(1)①2CO+O2+4OH-![]() 2CO32—+2H2O。②CO-2e-+O2-
2CO32—+2H2O。②CO-2e-+O2-![]() CO2。
CO2。
(2)①钠和氢。②增大。1mol。③使氢氧化铜分解、降低联氨的溶解度,使其从溶液中逸出。
(3)4CO+2SO2=4CO2+S2。
【解析】试题分析:(1)①该燃料电池中,负极上CO失电子发生氧化反应生成二氧化碳,正极上氧气得电子发生还原反应生成氢氧根离子,二氧化碳和氢氧根离子反应生成碳酸根离子和水,所以电池反应式为2CO+O2+4 OH-="2" CO32-+2H2O,故答案为:2CO+O2+4 OH-="2" CO32-+2H2O。
②d电极上CO生成二氧化碳,则该电极上失电子发生氧化反应,电极反应式为CO+O2--2e-=CO2,故答案为:CO+O2--2e-=CO2;
(2)根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②Cu(NH3)2+和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子,所以溶液的pH增大;转化中当有1mol N2H4参与反应时,转移电子物质的量=1mol×2×[0-(-2)]=4mol,根据转移电子相等得需要消耗O2的物质的量=![]() =1mol,故答案为:增大;1mol;
=1mol,故答案为:增大;1mol;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,故答案为:氢氧化铜分解、降低联氨溶解度使其从溶液中逸出;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,所以反应方程式为4CO+2SO2=4CO2+S2,故答案为:4CO+2SO2=4CO2+S2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33
【题目】无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是________。

(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学 式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O |
(3)写出⑦转化为⑤的化学方程式______________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是________________。


