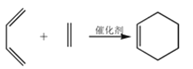
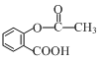
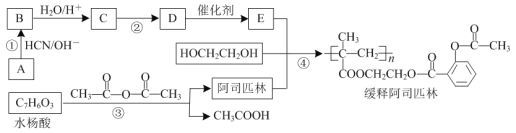
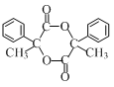
题目内容
【题目】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
________NaBiO3+________Mn2++________________![]() ________Na++________Bi3++_______________+______________。
________Na++________Bi3++_______________+______________。
【答案】5 2 14 H+ 5 5 2 MnO4- 7 H2O
【解析】
MnO4-的水溶液显紫色,在酸性条件下NaBiO3被MnSO4还原为Bi3+,Mn2+被氧化为紫色的MnO4-,同时产生水,根据电子守恒、电荷守恒、原子守恒,书写方程式。
在该反应中,Bi元素化合价由反应前NaBiO3中的+5价变为反应后Bi3+的+3价,降低了2价,Mn元素化合价也由反应前+2价的Mn2+被氧化为+7价的MnO4-,化合价升高了5价,根据元素化合价升降总数相等,可知NaBiO3、Bi3+的系数是5;Mn2+、MnO4-的系数是2,根据Na守恒,可知Na+的系数是5,根据电荷守恒,可知H+的系数是14,结合原子守恒,可知反应产生的H2O的系数是7,反应的离子方程式为:5NaBiO3+2Mn2++14H+=5Na++5Bi3++2MnO4-+7H2O。

练习册系列答案
相关题目