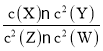题目内容
【题目】某工厂排放出有毒物质NOCl,它遇水就会生成NO3-,NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为______。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为______。
【答案】![]() 10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O
10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O
【解析】
NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子共用2对电子,与氯原子共用1对电子;根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、AlO2-,根据电子守恒和原子守恒书写方程式并计算即可。
NOCl分子中各原子均满足8电子稳定结构,则氮原子与氧原子共用2对电子,与氯原子共用1对电子,电子式为:![]() ;
;
根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、AlO2-,反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2,氮元素化合价由+5价降低为0价,生成1个N2共降低10价,化合价升、降最小公倍数为30,则Al、AlO2-的系数是10,NO3-的系数是6,N2的系数是是3,根据电荷守恒,可知OH-的系数是4,最后根据原子守恒可知H2O的系数是2反应的离子方程式:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。

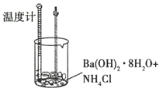
【题目】某实验探究小组进行如下实验,探究化学反应中的能量变化。
实验① | 实验② |
|
|
温度计读数升高 | 温度计读数降低 |
下列判断一定正确的是( )
A.实验①的反应中化学键断裂吸收的能量大于实验②
B.实验①的反应中化学键断裂吸收的能量小于实验②的反应中化学键形成放出的能量
C.实验①说明中和反应放出热量
D.实验②说明所有有氨气生成的反应均吸收热量