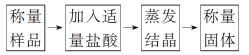
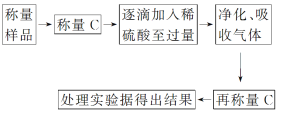
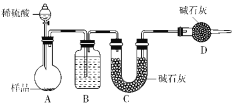
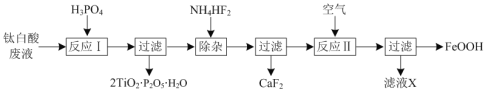
题目内容
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知![]() 能发生如下反应
能发生如下反应
_______NaNO2+_____HI——_________NO↑+_________I2+_______NaI+____H2O
(1)配平上面方程式。
(2)若有1 mol的氧化剂被还原,则被氧化的还原剂是 ________mol。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是_____(填字母)。
A.①②④ B.③⑤ C. ①②③⑤ D.①②⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______
【答案】![]() 4 2 1 2 2 1 D NaNO2+NH4Cl=N2↑+NaCl+2H2O
4 2 1 2 2 1 D NaNO2+NH4Cl=N2↑+NaCl+2H2O
【解析】
(1)在反应中N、I元素化合价发生了变化,先根据元素化合价升降总数相等,配平参加氧化还原反应的元素,再根据原子守恒,配平未参加氧化还原反应的元素,得到方程式;
(2)根据元素化合价升高与降低的数值,确定还原剂的物质的量多少;
(3)在酸性条件下NaNO2可以将I-氧化为I2,I2遇淀粉溶液变为蓝色检验;
(4)NaNO2与NH4Cl发生氧化还原反应产生N2、NaCl、H2O。
(1)在该反应中,N元素从+3降低到+2,共降低1价,碘元素从-1升高到0价,反应产生一个碘单质共升高2价,依据化合价升降总数相等,NaNO2、NO的系数是2,HI系数是2,I2的系数是1,再配平未参加氧化还原反应的元素,Na反应前有2个,则NaI的系数是2,有2个I未参加氧化还原反应,所以HI的系数改为4,根据H原子个数反应前后相等,可知H2O的系数是2,所以配平后的化学方程式为2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,因此配出系数由前到后依次为:2、4、2、1、2、2;
(2)在上述反应中NaNO2为氧化剂,HI为还原剂,1 molNaNO2反应,得到1 mol电子,根据氧化还原反应中元素化合价升降总数相等,可知被氧化的还原剂的物质的量是1 mol;
(3)根据上述反应可知:在酸性条件下NaNO2可以将I-氧化为I2,可根据I2遇淀粉溶液变为蓝色检验,故鉴别NaNO2和NaCl可以用①水、②碘化钾淀粉试纸、⑤食醋,故需要的物质序号为①②⑤,合理选项是D;
(4)NaNO2与NH4Cl发生氧化还原反应产生N2、NaCl、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式为:NaNO2+NH4Cl=N2↑+NaCl+2H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案